分子イメージング薬剤の開発、
評価の基礎研究に Initiator+ Alstra を活用
群馬大学大学院医学系研究科
バイオイメージング情報解析学講座
花岡宏史特任准教授

群馬大学大学院医学系研究科バイオイメージング情報解析学講座では分子イメージング薬剤に関する研究をされています。この研究では生体内におけるペプチドやタンパク質などの分子の挙動を画像としてとらえることで、がんの早期発見や治療効果の予測を目指しています。そしてイメージング薬剤の母体化合物となるペプチドの合成に全自動マイクロウェーブペプチド合成装置 Initiator+ Alstra を導入しご活用いただいています。今回は花岡宏史特任准教授にお話をうかがいました。
― まず、ご研究内容について教えてください。
 花岡先生 :
花岡先生 :
PET『positron emission tomography (陽電子放出断層撮影)』検査が臨床現場でがんの診断に利用されるようになっています。PETでは放射性核種で標識した化合物を生体内に投与して観察しますが、現在使われているポジトロン放出核種の半減期は短い(2-110分)ので病院内の加速器で投与前にポジトロン放出核種を製造し標識化合物を合成するのが一般的です。PETの使い道をもっと広げるには、より利用しやすいPET薬剤の開発が必要とされています。
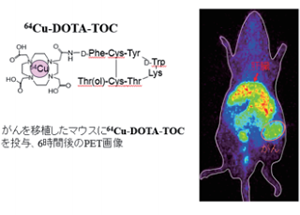
PET検査でよく用いられる腫瘍診断薬では放射性フッ素でグルコースを標識した18F-FDGがありますが、私たちの研究では半減期がより長くて検査で使いやすいポジトロン放出核種の76Brや64Cuなどを利用した分子イメージングプローブの開発や評価を行っています。
― 今より使いやすいPET薬剤にするため、新たな放射性核種を用いた検討を始めたわけですね。
どのような成果があったのでしょうか?
花岡先生 :
まず64Cuですが、大腸がんの分子標的治療薬として使われているモノクローナル抗体のセツキシマブと組み合わせてみました。大腸がん細胞を移植したマウスに64Cu標識セツキシマブを投与しPET撮像することによるイメージングを試み、明瞭に腫瘍を画像化することができました。実際にセツキシマブによる治療を行う前に64Cu標識セツキシマブPET画像を撮影してチェックする。そうすることで腫瘍への放射性核種の集まり方を見れば治療時にセツキシマブを投与したらどのくらい腫瘍に集積するかを予測し、セツキシマブ治療に適した患者を選定することができる。こうした成果が期待できます。
 もう一つの76Brですが、こちらは褐色細胞腫を移植したマウスに76Brで標識したMBBG(メタブロモベンジルグアニジン)を投与する実験を行いました。その結果、76Br-MBBGが腫瘍に集積しこれまで難しかった小さな腫瘍も可視化できるようになりました。褐色細胞腫のPET診断は行われていませんでしたが、76Br-MBBGは褐色細胞腫のPET診断薬として使える可能性がでてきました。
もう一つの76Brですが、こちらは褐色細胞腫を移植したマウスに76Brで標識したMBBG(メタブロモベンジルグアニジン)を投与する実験を行いました。その結果、76Br-MBBGが腫瘍に集積しこれまで難しかった小さな腫瘍も可視化できるようになりました。褐色細胞腫のPET診断は行われていませんでしたが、76Br-MBBGは褐色細胞腫のPET診断薬として使える可能性がでてきました。
◆Initiator+ Alstra活用で最適なペプチドを合成、時間とコスト削減でも効果
― ポジトロン放出核種で標識した化合物を放射性薬剤として利用するわけですが、そこでペプチドはどのように使われるのですか?
花岡先生 :
放射性核種を標的部位に運搬する化合物の母体となるものには抗体や低分子化合物など色々あります。その一つにペプチドがあり、ペプチドを母体とし放射性核種で標識した化合物を投与してがんのイメージングすることを研究しています。
― 母体化合物となるペプチドにもさらにまた色々あるかと思いますが、どのようなペプチドをどうやって選んで使うのでしょうか?
花岡先生 :
母体となるペプチドをどのようなものに選ぶかですが、オリジナルでゼロから作り出すのでなく論文で報告されているものから主に探しています。標的となるがんに特異的に発現しているような受容体等の分子に対して結合するペプチドが論文で報告されていますが、そうしたペプチドを見つけてきてそれに放射性核種をつけてイメージングに使えるか調べてみる。こういう研究の流れでやっています。
― そうすると当初からペプチドを作るのが目的でなく、着目したペプチドがイメージング薬剤として有効かどうか評価するということですね。 どのような経緯で全自動ペプチド合成装置を導入することになったのでしょうか。
花岡先生 :
論文で報告されているような短いペプチドを探しては試していましたが、ペプチド合成装置はありませんでした。それでも受託で安く作れるようになっていましたから受託合成で作ってもらったものを少量買ってきて、それに放射性核種をつける作業を行っていました。
ペプチドを探すにあたっては親和性が高いものを選んでいましたが、実際に薬剤としての評価のためマウスに投与すると入れた途端にペプチドが分解してしまって、集まって欲しい腫瘍に全然集まってくれないことが多かった。そこで結局自分でペプチドを改良したりして、それを受託にオーダーするという形でやるようになりました。
そのうち予算が頂けることになって、これを機にペプチド合成装置を買えば自分でデザインした、もっと最適化したペプチドを作ることができる、研究が捗ると考えて導入しました。
― 最適なペプチドを作るために導入したということですが、受託に出すより自分で作った方が早いというのもありましたか?
花岡先生 :
受託では望み通りのものを作ってくれますが色々と時間がかかります。それを考えるとコストはトータルで安くならないにしても自分の研究室で作れた方がいいかなと考えるようになったわけです。それに受託ですと特殊なアミノ酸を入れたりすれば値段が急に高くなったりするので、そういう点でも自分で作った方がいいのではと考えました。
◆短時間での合成で力を発揮、マイクロウェーブ方式の合成装置
― ところでInitiator+ Alstraを導入する前に有機合成装置Initiator+も導入されましたが、こちらはどのように使われているのでしょうか。
花岡先生 :
ポジトロン放出核種標識の合成を短時間で行う際にはマイクロウェーブ方式が有効といわれているので、有機合成装置はその目的で放射性核種を扱う施設に導入されています。今日も使ってきました。
― なるほど、全くの別用途でのご使用なんですね。ペプチド合成装置の方ですがこちらもマイクロウェーブ合成方式にされたのはなぜでしょうか?
花岡先生 :
同じ大学の理工学部でペプチドをやっていて、そことは以前から一緒に仕事をしていましたが、そちらの先生と話をする中でペプチド合成ではマイクロウェーブがいいよと聞いて、それでこの装置を導入という流れでした。
群馬大学では理工学部と医学部の連携での研究も行っていて両学部の間では交流があります。その理工学部の先生からマイクロウェーブを使ったペプチド合成装置の話を聞いたわけです。理工学部では特殊なペプチドを作ったりしているので装置に関心があって、それでマイクロウェーブの装置情報を得たと聞いています。
それから64Cuのような金属はペプチドと直接は結合ができないので、64Cuをキレートに組み込んでそれを介してペプチドに結合させるよう方法をとっています。しかしこれでは組み込むことはできても元のペプチドと体内動態が違ってきてしまいます。そこで放射性核種をペプチドの一部として組み込んだペプチドを作れば元のペプチドと相同性の高いものが作れると考えました。それには前駆体となる特殊なアミノ酸を入れる必要がありますが、ここでもマイクロウェーブを使うペプチド合成装置が役立つのではと思っています。
― マイクロウェーブ方式の装置も含めペプチド合成装置には色々な種類があります。弊社製品でもInitiator+ Alstraの他にも全自動パラレルペプチド合成装置がありますが、同時にたくさんのペプチドを合成することには関心なかったのでしょうか?
花岡先生 :
確かにパラレルの装置なら一度にたくさんのペプチドを合成できますが、作ってからマウス等で物性評価をしなければならないので、あまりたくさん作っても評価しきれないというのがあります。それにポジトロン放出核種の半減期は短いですから、この点からしても大量に作っても一気に評価する余裕はありません。
◆より安定した親和性のあるペプチド合成に、Initiator+ Alstraのさらなる活用を期待
 ― がんのイメージング薬剤開発にInitiator+ Alstraを使っておられますが、そこで得られたノウハウは今後ほかにどのような形で応用することが期待できるでしょうか?
― がんのイメージング薬剤開発にInitiator+ Alstraを使っておられますが、そこで得られたノウハウは今後ほかにどのような形で応用することが期待できるでしょうか?
花岡先生 :
現在は、がんのイメージング薬剤にペプチドを母体として使っていますが、ペプチド自体の体内動態を追うためのツールとして放射性核種を目印として使うこともできるのではと考えています。放射性核種によるイメージングを、単にがんの診断だけでなくペプチドの動態追跡に使うことも考えられるのです。
ペプチドを母体にしたイメージング薬剤の開発は世界でかなり行われていますが、ペプチド自体に標識をつけて体内動態の追跡する研究は多分殆どやられていないと思います。
― なるほど、今までの研究から別の発想が生まれたわけですね。研究を進めるうえでのテーマや決め手となるのはどのようなことでしょうか?
花岡先生 :
標的分子のイメージング薬剤としてペプチドを使うのだからいかに安定で親和性をもつペプチドを開発できるかということではと思います。それには色々と作っては試してみるしかないというのもありますが(笑)。
― 安定したペプチドを作るのに一役買いそうなツールとしてInitiator+ AlstraのBranches機能があります。環化反応や側鎖合成をタッチスクリーン上の設定で簡単にできる機能で、環状ペプチドの合成が行えます。
花岡先生 :
そのような便利な機能があったんですね。導入時の取扱説明で聞いたかもしれません・・・。
― ご説明不足で申し訳ございません。環化を視野に入れてペプチド合成に取り組んでいる方は多いのですが、Branches機能についてお話しすると研究者の方から「そういう機能があるんですか」と言われたりします。私どもがもっとアピールしてご活用頂ければと思っている機能です。
◆PCでもデータ共有できるようになればさらに便利
― Initiator+ Alstraを実際にご使用された上での操作性について感想やご要望はございますか?
花岡先生 :
画面は操作しやすいです。スマホのような感覚でセッティングできる感じです。操作や設定はInitiator+ Alstraを立ち上げて装置のパネル上で行うことになりますので、研究室のPCでもデータの共有ができるようになれば有り難いですね。
また、装置の使い勝手ですが、合成作業中に不活性ガス雰囲気にするため窒素を流していますが、使用量が多いように感じます。
 ― そうですね、データ共有できることで効率はグンと上がりますね。ぜひ、このようなご意見を活かしていきたいと思います。窒素パージについては、Initiator+ Alstraはラック毎の局所パージで消費を抑えておりますが、合成中は流れ続けますので消費が多いと感じるかもしれませんね。
― そうですね、データ共有できることで効率はグンと上がりますね。ぜひ、このようなご意見を活かしていきたいと思います。窒素パージについては、Initiator+ Alstraはラック毎の局所パージで消費を抑えておりますが、合成中は流れ続けますので消費が多いと感じるかもしれませんね。
花岡先生 :
それと合成後の精製ですがこれはHPLC法でやっていますがこの作業にかかる手間も減らせたら助かります。
― 精製ではフラッシュ自動精製装置という選択肢もございます。100mgを超える様な化合物の分取には便利です。機会がございましたらお試しいただければ幸いです。本日は誠にありがとうございました。
インタビュー実施:2016年11月8日
PDFファイルダウンロード(1.7MB)
導入製品
全自動マイクロウェーブ ペプチド合成装置
『Initiator+ Alstra』
URL: https://www.biotage.co.jp/products_top/peptide-synthesis-purification/initiator_alstra/
ユーザーフレンドリーなタッチパネル操作、優れたマイクロウェーブ照射による効率的な加熱反応、デジタルシリンジポンプによる正確な試薬送液により、高精度かつ可能性の広がるペプチド合成を行えます。
導入機関
群馬大学
1873年(明治6年)創設の群馬師範学校が前身で、医学部は1943年(昭和18年)創設の前橋医学専門学校に始まります。その後前橋医学専門学校は前橋医科大学を経て1949年(昭和24年)に群馬大学医学部となり現在に至っています。群馬大学のキャンパスは桐生や太田にもありますが、医学部は附属病院とともに前橋にあって地域の医療と研究活動の中核機能を担ってきました。インタビューで共同研究のお話のあった理工学部は2013年(平成25年)に工学部から改組して現在の理工学部となっています。
