抗菌ペプチドの構造-機能解析研究に
Initiator+ Alstra を活用
横浜国立大学大学院 工学府 機能発現工学専攻
先端物質化学コース 川村研究室

横浜国立大学大学院 工学府 機能発現工学専攻の川村研究室のグループでは、抗菌ペプチドの構造を調べ、機能発現するメカニズムを明らかにする研究を行っています。構造解析の際に必要なペプチドの合成に、全自動マイクロウェーブペプチド合成装置「Initiator+ Alstra」をご活用いただいています。今回は川村出准教授と、大学院生の北橋由貴さん、金田志穂さんにお話しをうかがいました。
─ まず、ご研究内容について教えてください。
川村先生 :
私たちの研究室では抗菌ペプチドの構造を調べ、機能発現に至るメカニズムを明らかにする構造-機能相関の研究を行っています。数多くある抗菌ペプチドの中でも、私たちはカエルの皮膚分泌物に含まれる抗菌ペプチドに注目し、メカニズムを調べています。
キバラスズガエルというヨーロッパに生息しているカエルは、その皮膚にイソメラーゼという酵素を持ちます。ほとんどの場合、ペプチドは天然に存在するL体のアミノ酸によって構成されていますが、このキバラスズガエルの皮膚分泌物にあるペプチドは、アミノ酸の配列は同じまま2残基目のアミノ酸だけがイソメラーゼ酵素によりD体のアミノ酸に変換されているのです。
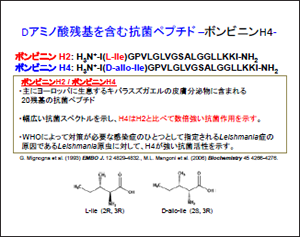 D体アミノ酸残基を持つペプチドはボンビニンH4と呼ばれていますが、驚くことにボンビニンH4は、L体で構成されているボンビニンH2に比べ、ほとんどの細菌に対して強い抗菌作用を示します。
D体アミノ酸残基を持つペプチドはボンビニンH4と呼ばれていますが、驚くことにボンビニンH4は、L体で構成されているボンビニンH2に比べ、ほとんどの細菌に対して強い抗菌作用を示します。
温暖な熱帯地域を中心に問題となっているリーシュマニア感染症の原因となる原虫に対しても、ボンビニンH4が効果的に働くことでバクテリアが死ぬと推測されています。この興味深い性質を明らかにするために、抗菌ペプチドであるボンビニンH4に注目し、反応場である細胞膜中での構造解析に取り組んでいます。具体的には1アミノ酸残基の側鎖のキラリティーによって、抗菌活性がなぜ変化するのかを調べるというものです。構造を理解することによって新たな試薬がつくれるのではないかと思っています。
─ 抗菌というテーマで、カエルに注目されているというのはとても面白いですね。アミノ酸をD体に変換する機構は、カエルの中でも珍しいのでしょうか?

機能発現工学専攻 先端物質化学コース
川村出准教授
川村先生 :
よくよく調べてみると、カエルがそもそも持っている機構ではないかと言われています。実際にカエルから抽出したペプチドにD体アミノ酸が含まれていることが多いですし、抗菌ペプチドをたくさん持っていることも報告されています。
カエルは水中と陸を行き来するため、他の生物より多くのバクテリアの攻撃を受ける環境におり、様々な細菌から寄生されるのを防げるよう抗菌機構を備えているという記事を読んだことがあります。
抗菌ペプチドが活性を示す細菌の中には、私たちにとって深刻な感染症を引き起こすものもあります。この抗菌ペプチドの構造や機能がわかれば、先程お話したリーシュマニア感染症以外にも、さまざまな病気を治す、また予防などに応用できるのではないかと私たちは信じています。
─ カエルの抗菌ペプチドを参考にした薬が開発されるかもしれないのですね。
川村先生 :
そうですね。ただ創薬の可能性だけではありません。もうひとつ私たちが研究している抗菌ペプチドにDフェニルセプチンというものがあります。
ブラジルやアルゼンチンは大豆の生産量が高いのですが、大豆の葉を枯らし、収穫量や品質を下げる大豆葉焼病菌というバクテリアが存在するのです。ある研究者が南米に生息するブチアマガエルを調べたところ、このカエルには2残基目のフェニルアラニンがD体になっている抗菌ペプチドを持つことがわかりました。このフェニルアラニンがD体になっている抗菌ペプチド(Dフェニルセプチン)の方が、L体のものよりも大豆葉焼病菌に対し抗菌活性が強かったのです。
大豆の生産をこのカエルが支えているかもしれない、というのは面白いですよね。Dアミノ酸を含む抗菌ペプチドを利用することによって、国際的な課題を解決していくことが期待できます。
─ ブチアマガエルの場合もなぜか2残基目なんですね。
川村先生 :
なぜ2残基目なのか、それも調べていきたいと思っています。
◆細胞膜中での分子構造解析には、合成が不可欠
─ こうした興味深いご研究の中、ペプチド合成が必要なのはどうしてなのでしょうか?

横浜国立大学大学院 工学府 機能発現工学専攻
先端物質化学コース 川村研究室
修士課程2年 北橋 由貴さん
修士課程1年 金田 志穂さん
川村先生 :
構造解析に用いる手法はさまざまな物理化学計測がありますが、私たちは固体NMR分光法を用いています。固体NMR分光法は、細胞膜中での分子構造を調べることができるのが利点です。ですが固体NMR分光法での解析には、大量のペプチド試料が必要になります。そのため合成したペプチドを用いて、細胞膜中での構造解析を行っています。私たちにとって、ペプチド合成装置は研究に欠かせないのです。
─ カエルから抽出するのではないのですね。研究室にカエルがたくさんいるのかと思っていました(笑)。
川村先生 :
それはよく聞かれますね(笑)。人工で作っているため、残念ながらこの研究室ではカエルは扱っていません(笑)。研究が進めば、最終的にはカエルの皮膚から抽出したペプチドを用いて調べる必要もあると思っています。
─ 弊社のInitiator+ Alstraをご使用いただいたきっかけを教えていただけますか?

Initiator+ Alstra
川村先生 :
以前は、上司の教授がすでに持たれていた他社のペプチド合成装置を使って合成していました。その装置は非常に古く、メンテナンスに時間が取られてしまっていました。保守も終了してしまい、故障しても交換するパーツもないとのことでした。更新しなければならないと考え始め、いろいろ探したり相談したりしました。
まず自分で探した際には、あまり良いものがヒットしませんでした。そこで信頼できる出入りの業者さんに相談したところ、価格的にも性能的にも、バイオタージさんのものがいいと勧められました。サポートが充実していると聞けたことも大きかったですね。
そこでバイオタージさんに来ていただいて、パソコンで画面などの操作を見せていただきました。他社装置との比較やストロングポイント、ウィークポイントもきちんと教えてくださいました。
◆より多く実験するためには、マイクロウェーブで合成時間の短縮を
─ 最終的に導入を決めたポイントはなんだったのでしょうか?
川村先生 :
今まで使っていた装置や他社装置と決定的に違うのは、スマートな装置で、ボンベフリーな点でした。Initiator+ Alstraはデジタルシリンジポンプによる送液タイプなので、ボンベがいらず、その分のスペースも必要ありません。限られた実験スペースを考えると、とても良い点でした。
購入の際の決め手として、マイクロウェーブで合成できるという点もありました。ボンビニンH2、ボンビニンH4はそれほど合成が難しくないペプチドだと思っていますが、それらの物理化学的なパラメーターの差を出すには数多くのペプチドを使った実験をする必要があります。反応速度の短縮はとても大きいですね。
何度かペプチドケミストの方ともお話するなかで、たしかに導入後も充実したサポートが得られそうだなと実感することができました。その点も大きかったと思います。
ペプチド合成装置としては価格も手ごろでしたし、こういった色々な点を踏まえ上司の先生とも相談してInitiator+ Alstraが良いと決め、2014年の9月に導入しました。
◆準備・反応・メンテナンスなど、ペプチド合成に掛かる時間が飛躍的に改善
─ 実際に使われてみていかがですか?
北橋さん :
合成が早いのがいいですね。それはとても実感しています。カップリングがだいたい5分程度で行えます。これまで1残基で2時間、20残基だと40時間くらいかかっていましたが、Initiator+ Alstraでは20残基だと15、6時間くらいで合成できます。半分以下の時間で合成できるのです。その分、溶媒量が少なくてすみますし、溶媒補充の手間が省けます。洗浄も楽になりました。
また、準備に時間を取られなくなったのも嬉しいですね。アミノ酸の試薬をつくって装置にセットするのですが、以前の装置ではペプチド残基数分のアミノ酸を準備していました。F-F-D-T-Lなら5個の容器にF、F、D、T、Lと。1残基目と2残基目が同じアミノ酸だったとしても、別々の容器に準備する必要がありました。Initiator+ Alstraになってからは、同じアミノ酸はひとつの試薬ボトルに準備するだけで済みます。つまり、必要なアミノ酸の“種類”の数だけ準備すれば良いので、F-F-D-T-LならF、D、T、Lと4つだけで良いのです。20残基のペプチド合成などでは、準備だけでとても大変でした。今は準備が楽になった分、合成に掛ける時間も短くなった、という感じがします。
 川村先生 :
川村先生 :
アミノ酸ラックが32個あることもとても良いですね。私たちはさまざまなバリエーションのペプチド合成に取り組んでいる段階です。天然のアミノ酸は20種類ですが、D体を用いることでさらに1種類増えます。また私たちはNMRを使っているので、NMR測定をするためには13Cまたは15N安定同位体標識アミノ酸を使う必要があります。それだけで扱うアミノ酸の種類が増えていきます。
北橋さん :
また以前のものは、送液ラインに試薬が詰まることが多く、メンテナンスが大変でした。今思えば、実際の合成以外の所でかかる時間が長かったと感じますね。Initiator+ Alstraはメンテナンスの必要がほとんどありません。
金田さん :
導入してからほとんどメンテナンスをしてないですね。(笑)
◆使いやすい操作画面・ ペプチドケミストのアドバイスが合成をサポート

Initiator+ Alstra
川村先生 :
また、今の若い人たちはタッチパネルの方が操作方法を理解しやすいようですね。より直観的に操作することが出来て、学生もストレス無く操作できていますね。
北橋さん :
バイオタージさんのペプチドケミストの方には何度も研究室に足を運んでいただき、ペプチドにあった細かな合成計画を教えていただきました。メールで問合せても、すぐに回答が来てとても助かっています。
─ 導入後、研究への変化などはありましたか?
川村先生 :
ペプチド合成に関して、私も学生も昔は面倒くさいな、と思っていたと思います。Initiator+ Alstraを導入して、私も気軽に頼めるようになりましたし、学生も敷居が低くなって取り組みやすくなったようです。次はこれをやろうという展開も増えますよね。
実際にマイクロウェーブのアシストによって、今までよりも多くの量のペプチドを短時間で合成できるようにもなりました。固体NMR法による構造解析だけでなく、他の物理化学計測についても余裕をもって実行することができ、研究を推進したことは間違いないと思います。ペプチド合成にかかる時間は飛躍的に改善され、むしろその後の精製作業が律速になっているくらいです。
◆エラーなどにも対応できるよう日本語表示に
─ ご研究に少しでも貢献でき、とても嬉しいです。最後に、問題点や要望はございますか?
北橋さん :
問題点を挙げるとすれば、外国で作られたものなので、取扱い説明書も含めて表記が英語です。エラーや複雑な操作だとわからなくなることがあります。スマホのように言語を変えられる機能があればいいなと思います。
金田さん :
あと、溶媒瓶の蓋が置いているだけというか、完全に密閉されていません。合成中、臭いがするのが少しだけ気になりますね。
川村先生 :
今後も興味深いアミノ酸配列を持った新たなペプチドの構造解析に挑んでいくことになると思います。Initiator+ Alstraの導入台数が増えてくるとサポートの点が薄くなっていくことが心配になってきますので、今以上のサポート体制を築き上げていただくことを期待しています。
─ サポートも含め、より一層ご研究に貢献できるような装置にしていきたいと思います。本日は誠にありがとうございました。
インタビュー実施:2015年12月
PDFファイルダウンロード(1.85MB)
導入製品
全自動マイクロウェーブ
ペプチド合成装置
Initiator+ Alstra
URL: https://www.biotage.co.jp/products_top/peptide-synthesis-purification/initiator_alstra/
マイクロウェーブにより全自動でペプチド合成を行うことができる装置です。マイクロウェーブを用いることで、従来の方法では困難だった配列や、単純なペプチドをより効率的に合成することが可能です。
導入機関
国立大学法人 横浜国立大学
1876年、横浜市中区花咲町に開学した横浜師範学校が前身で、神奈川師範学校、横浜経済専門学校、横浜工業専門学校などが統合され、1949年に横浜国立大学となりました。当初は学芸学部、経済学部、工学部でスタートし、1979年に現在ある同市保土ヶ谷区常盤台に全学部が移転しました。現在は4学部、5大学院で構成されています。(データは2015年5月現在)理工学部の川村研究室では、生体分子の働きを分子レベルで理解することを目指し、研究を行っています。
(川村研究室HP:http://www.ikawamura.ynu.ac.jp/)
