December 17, 2020
Elizabeth Denton
最近、初めてフラッシュ精製に挑戦するペプチドグループと仕事をするようになりました。そして、必ずと言っていいほど、”このフラッシュ精製カートリッジにはどの程度の流速で使用すればいいのでしょうか?”という質問をたびたび聞かれます。HPLCのメソッド開発に最適な流速を強調する情報はたくさんありますが、フラッシュ精製のような粒子の大きな固定相に関する情報はほとんどありません。私自身、ペプチド精製に様々な流速を用いてきましたが、その結果は色々ありました。
そこで、本日の投稿では、移動相の流速とそれがクロマトグラフィーに与える影響について、より徹底的な議論を行いたいと思います。
流速は、分離能、効率、そして重要なことに精製時間に影響を与えます。フラッシュクロマトグラフィーを精製技術として使用することを決定する場合、ランタイムは重要な検討事項になります。しかし、速いことが常に良いとは限りません。流速が速いと、ペプチドが固定相と相互作用する機会が減少し、分離能が低下することがあります。一方、流速が遅すぎると、カラム上での拡散によりピーク幅が大きくなる可能性があります。
同僚のBob Bicklerと何度か有益な議論をした後、今回の投稿の着想を得ました。彼は、おそらく私が知るよりもクロマトグラフィーのことを良く知っているでしょう。
Bobは低分子化合物の混合物を用いて、いくつかの異なるサイズの固定相粒子の流速の影響を評価する素晴らしい仕事をしていましたが、ペプチドはクロマトグラフィーに関して独自の考えを持っていることは周知の通りです。そこで、3種類の移動相の流速を試し、精製効率の違いを比較することにしました。そこで、DMSOに溶解した18Aペプチドを約250µL注入し、10カラムボリュームで20から70%のMeCNグラジエントを用いて精製しました。しかし今回は、12、25、50 mL/minの流速でグラジエントを行いました(図1)。
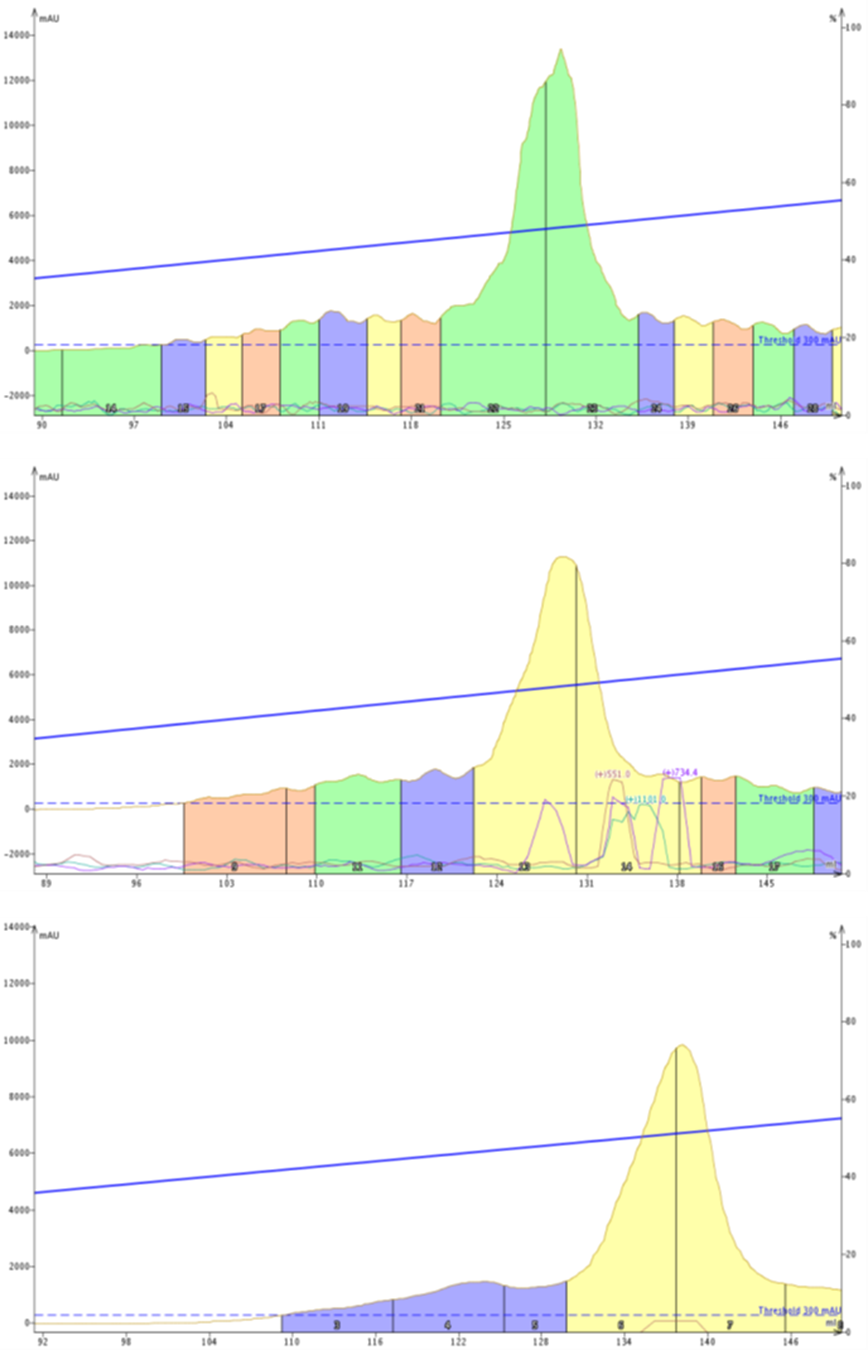
図1:12 (上)、25 (中)、50 mL/min (下) の流速で 20 から 70% のリニアグラジエントを使用して 18A を精製しました。同等のサンプル負荷にもかかわらず、ピーク幅と観測されたピーク振幅の両方において、ピークのブロード化が明らかに見られました。
それぞれの精製には、いくつかの違いがあります。まず、最も明らかなのは、最も速い流速で観察された保持の比較的大きな増加です(保持量は〜129 mLではなく、138 mLです)。通常、流速が速いほどペプチドは早く溶出すると予想されます。ペプチドは、精製中に固定相から脱離すると、より速くカートリッジから流出するはずだからです。
このことから、高圧下では、移動相が固定相とペプチドの相互作用においてより積極的な役割を果たし、分子を効果的に細孔に押し込んで相互作用を強制していることを示唆するいくつかの証拠を示しています。この現象は、速い流速で高い保持が見られるのかを説明することができます。
次に、流量が増加するとベースラインの揺らぎ(うねり)が減少することに気づくでしょう。変動が規則的であることから、システム的な問題があることが示唆されます。実際には、グラジエントの移動相中でアセトニトリルと水が混ざり合うことによるキャビテーションが観察されます。アセトニトリルと水が混ざると、溶液が冷却され、閉じ込められていた空気が排出され、気泡が形成されます。この気泡は小さな圧力変動を引き起こし、UV検出器によって検出されます。このキャビテーションは精製後のフラクション分析を複雑にしますが、この問題を軽減する別の方法について、今後説明したいと思います。
カラムの性能に関する技術的な内容をもう少し掘り下げると、一つのことが非常に明確になります。流速を上げると、ピーク幅が広がります(表1)。12 mL/minと25 mL/minの精製を比較すると、その影響はより微妙ですが、流速を50 mL/minに上げると非常に顕著になります。バンド幅の拡大は、分離能や純度の低下につながる可能性があり、特に溶出する欠損体や副生成物が密接に関係している場合は注意が必要です。
| 流量 (mL/min) |
保持量 (mL) | ピーク半値幅 (mL) | カラムあたりの理論プレート | 1メートルあたりの理論プレート |
|---|---|---|---|---|
| 12 | 129.5 | 5 | 3,716 | 67,568 |
| 25 | 129 | 6 | 2,561 | 46,561 |
| 50 | 138 | 8 | 1,648 | 29,972 |
表1:異なる流速によるリニアグラジエントのペプチド精製における見かけ上のカートリッジの精製効率の比較。
そこで問題になるのが、「何を妥協するか」です。分離を改善するために容易に変更できるパラメータがいくつかありますが、流速もその一つです。
ピーク幅が広くなるにもかかわらず、私はこのグラジエントと流速50mL/minを使用して、比較的純度が低い粗ペプチド(粗純度27%)を精製し、非常に高い純度(95%以上)を達成しました。 精製の所要時間は、最も速い流速では平衡化と洗浄を含めて約6分であるのに対し、最も遅い流速では約24分となりました。
ペプチドのフラッシュ精製でどのくらい流量で実施しますか?
ペプチド精製におけるフラッシュクロマトグラフィーの有用性について、さらに詳しく知りたいですか?
精製のヒントとコツに関してについてもっと知りたい方は、以下のURLからホワイトペーパーをご覧ください。
ホワイトペーパー:https://www.biotage.co.jp/white_paper/wp_pps510_achieve_highly_pure_peptides/
参考資料:
HPLCのメソッド開発: Restek HP (https://www.restek.com/global/ja/)
低分子の混合物: Setting the Right Flow Rate for Flash Column Chromatography (biotage.com)
分離に関するパラメータ:Six key factors that impact flash chromatography (biotage.com)
元の記事:What mobile phase flow rate should I use for my peptide purification with flash chromatography? (biotage.com)
日本語化:2024年8月
PDFファイルダウンロード(386KB)