December 31, 2018
Elizabeth Denton
私は最近、ジスルフィドを多く含むペプチドについて多くの実験を行い、鎖状での合成だけでなく、樹脂上での酸化反応によるシステインのジスルフィド結合形成にも有効な条件を見出しています。互いに独立した保護基の脱保護やシステインの酸化条件を決めるには、単純な配列が便利ですが、現在注目されているペプチドは、3つ以上のジスルフィド結合や、しばしばHead-to-tailの環状化など、より複雑なものが多くなっています。
本日の記事では、リナクロチドの全自動合成を最適化するために、3つのそれぞれのシステイン保護基の戦略について紹介します。
現在、慢性便秘症の治療薬として販売されているリナクロチドは、3つのジスルフィド結合を持つ14アミノ酸のペプチドになります(図1)。このユニークな配列は、完全自動化合成のソリューションが必要な場合、鎖状ペプチドの合成とジスルフィド結合の両方のパターンにおいて複雑な問題を解決する必要があります。
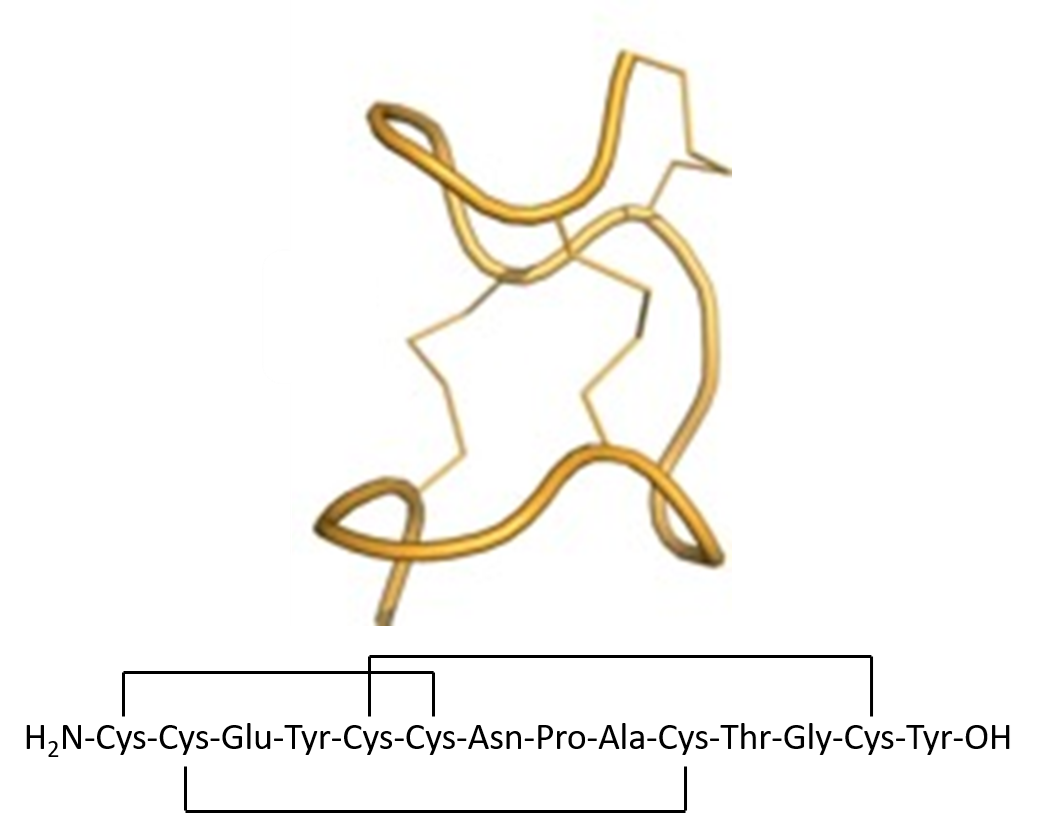
図1:リナクロチドの立体構造とアミノ酸配列。
手始めに、Mmt, Acmと STmpで側鎖を保護されたシステインを使用することにしました。これらの保護基は、過去に個別に扱ったことがあります。
しかし、すぐに出てきた最も重要な問題は、どの順番でジスルフィド結合を形成するかということになります。このジスルフィド結合形成の順序については、ジスルフィド結合を2つ持つアパミンの合成で、すでにいくつかお話ししました。
私の中では、アパミンについてはジスルフィド結合の形成順序は問題ないように思えたのですが、このペプチドはリナクロチドに比べて鎖状の配列が長く、かつジスルフィド結合の数が少なかったのです。
実際の合成に入る前の簡単なメモとして、複数の側鎖の保護基を使用する場合、脱保護条件の互換性を考慮することが重要になります。例えば、Acmの脱保護条件はMmtの保護基を酸化させるのに十分であり、目的以外のジスルフィド結合が生じる可能性があります。合成は、Initiator+ Alstra™のBranches™ソフトウェア機能を使用して、それぞれの位置にジスルフィド結合を選択的して形成反応の順序と関連する化学反応を割り当てました(図2)。
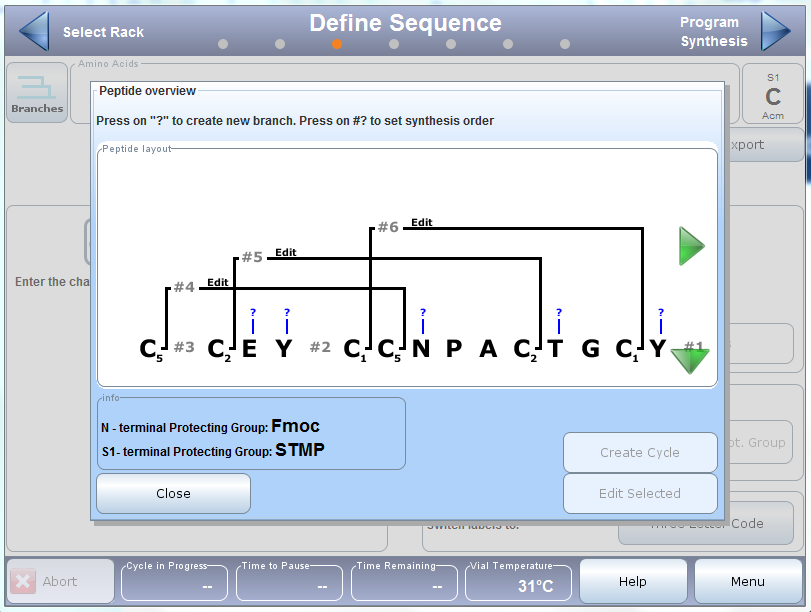
図2:リナクロチド配列をBranchで作成したもの。直鎖の配列とジスルフィド結合の結合性だけでなく、直鎖からジスルフィド結合形成の合成順序も表現しています。
そこで、まず Cys5-Cys13 のジスルフィド結合を形成し、次にCys2-Cys10 を形成し、最後に Cys1-Cys6 のジスルフィド結合を形成することにしました(図 3)。
すべてのジスルフィド結合を形成したHPLCを確認すると、多くのピークが検出され、これらは複数の不純物の存在を示唆しており、おそらく目的のペプチド生成物が誤って折り畳まれているか、不完全にジスルフィド結合が形成されたペプチドになっている可能性があります。そこで、私は初心に戻ることにしました。
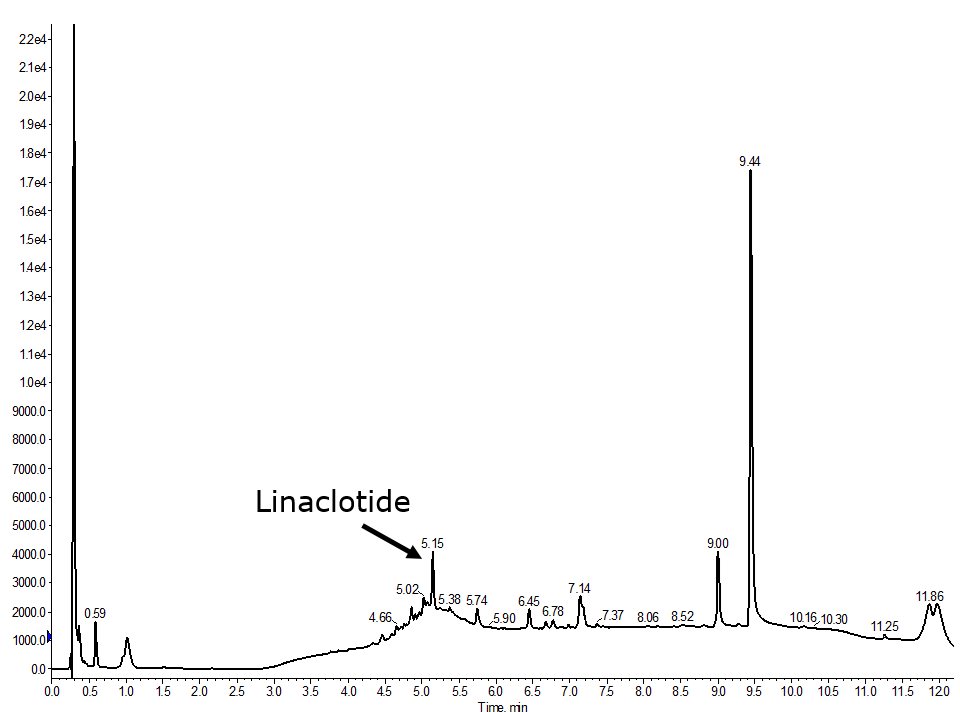
図3:完全自動化で合成したリナクロチドの分析用HPLCでは、まずCys3-Cys15のジスルフィド結合が形成され、次にCys2-Cys10、最後にCys1-Cys6が形成されました。
ジスルフィド結合の形成の順番を、まずCys1-Cys6、次にCys5-Cys13、最後にCys2-Cys10 の順序に変えると(直鎖配列の合成プロトコルに変更はありません)、状況は改善されました(図 4)。
生成物のピーク強度が増加しただけでなく、その周辺にある多くのピークが著しくシャープになり、ジスルフィド結合の形成効率が向上したことが示唆されました。
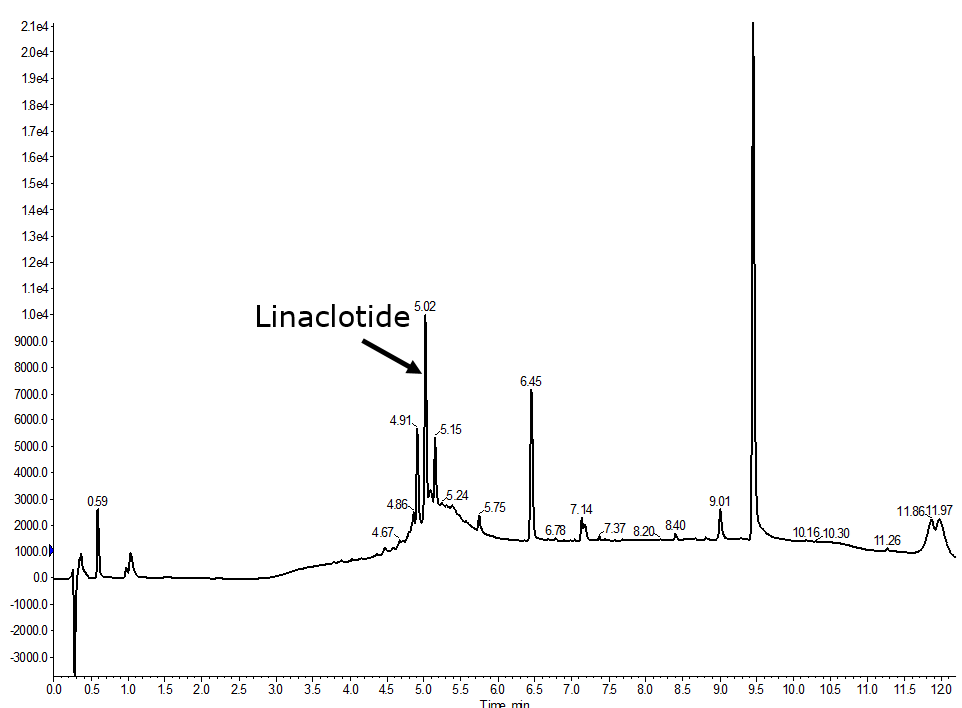
図4:完全自動化で合成されたリナクロチドの分析用HPLCでは、まずCys1-Cys6のジスルフィド結合が形成され、次にCys5-Cys13が形成され、最後にCys2-Cys10が形成されています。
文献を調べたところ、リナクロチドの最適化合成を詳述した論文が見つかり、特にジスルフィド結合形成の順序について詳しく書かれていました。彼らは今回使用したものとは異なる保護基のシリーズを使用していましたが、結合形成の順序が私にとって最も重要なことでした。最終的な合成では、まずCys1-Cys6結合を形成し、次にCys2-Cys10結合を形成し、最後にCys5-Cys13ジスルフィド結合を形成したところ、これまでのところ最も良い結果が得られました(図5)。
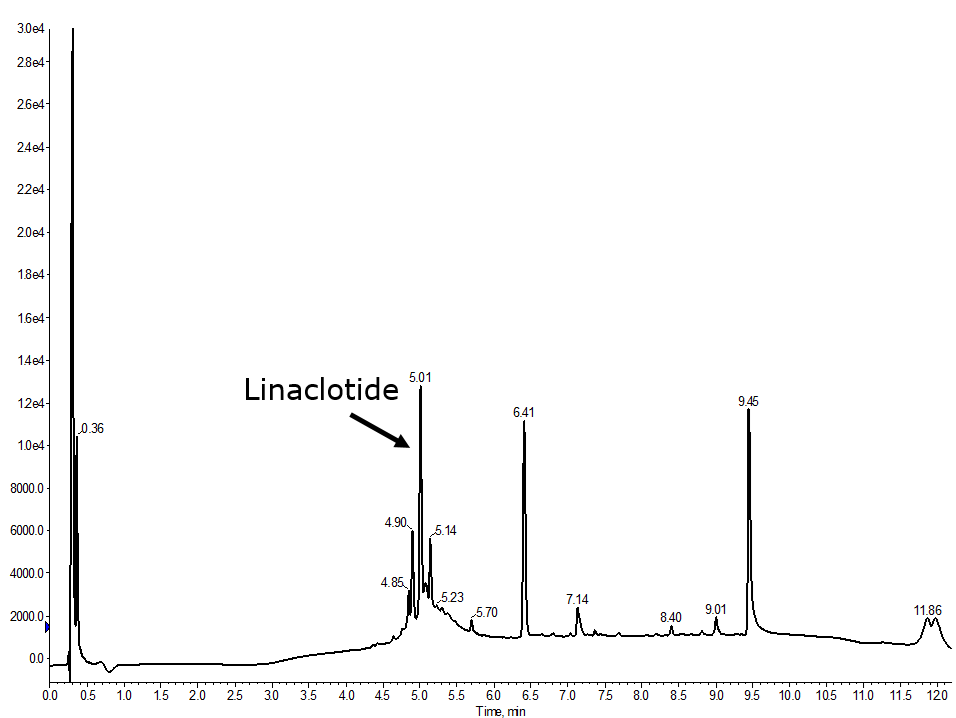
図5:完全自動化で合成されたリナクロチドの分析用HPLCでは、まずCys1-Cys6のジスルフィド結合が形成され、次にCys2-Cys10が形成され、最後にCys5-Cys13が形成されています。
リナクロチドの立体構造を見てみると、このジスルフィド形成順が最も成功しているのは、ある程度納得できます。Cys5-Cys13が最初に形成されると、N末端領域と樹脂そのものとの相互作用を促進するようなコンフォメーションを誘発し、他の2つのジスルフィド結合の形成が阻害される可能性が考えられます。
一方、Cys2-Cys10を2番目に形成すると、樹脂自体との相互作用の可能性はなくなり、鎖状の構造の変化が促進されます。重要なのは、Cys2-Cys10のジスルフィド結合は、Cys5とCys13が最終的なジスルフィド結合を形成するのに適した構造を形成していることです。
このプロセスは、多くのジスルフィド結合を含むペプチドの合成自動化を最適化するために必要とする手順の難しさを強調しています。head-to-tailでの環状化を追加するペプチドの場合、どれだけ複雑になるかを考えてみてください。
ジスルフィドが豊富なペプチドの合成についてもっと知りたい方は、以下のURLからウェビナーをご覧ください。
Webinar: https://www.biotage.com/blog/webinar-synthesizing-disulfide-rich-peptides
参考資料:
Mmt保護基: How To: Measure and Optimize the Removal of MMT Protecting Groups (biotage.com)
Acm保護基: Optimizing the removal of an ACM protecting group (biotage.com)
STmp保護基: Optimizing the removal of an STmp protecting group (biotage.com)
アパミンの合成:Disulfide Rich Peptides – which order should the disulfide bonds be formed? (biotage.com)
リナクロチドの最適化合成:Optimized Fmoc solid-phase synthesis of the cysteine-rich peptide linaclotide (Biopolymers, 96, 1, 2011, 69-80)
元の記事:Synthesis of peptides containing three disulfide bonds: can it be fully automated? (biotage.com)
日本語化:2024年6月
PDFファイルダウンロード(441KB)