September 29, 2020
Elizabeth Denton
最も興味深いペプチドが、絶対的に扱いの難しいペプチドであることがあります。合成の難しさ、溶解度の問題、精製の難しさ、あるいは最悪の場合、上記のすべてが重なったとしても、実験は続けなければなりません。現在多く研究されているアミロイド形成ペプチドのアミロイド β が取り扱いが難しいペプチドになります。
今回の投稿では、この特に取り扱いの難しいペプチドをケーススタディとして、精製効率を上げるための戦略をご紹介します。
特に β-アミロイドペプチドのファミリーは難しい…。配列に多くの疎水性アミノ酸を含み、その多くが40または42アミノ酸の長さに点々と集まっているため、合成を困難にさせています。さらに、樹脂から切り離した後のペプチドの取り扱いは、より大きな困難を伴います。溶解性が低く、溶液中で凝集したり、繊維上になる傾向が強いため、精製も非常に難しいペプチドになります。
全自動マイクロウェーブ合成装置 Biotage® Initiator+ Alstra™を使ってβ-アミロイド 1-40 を合成しました。合成プロトコルや樹脂からの切り出し・切り出し後の取り扱いについて考えるのにかけた労力を考えると、かなり良い結果が得られました(図1)。
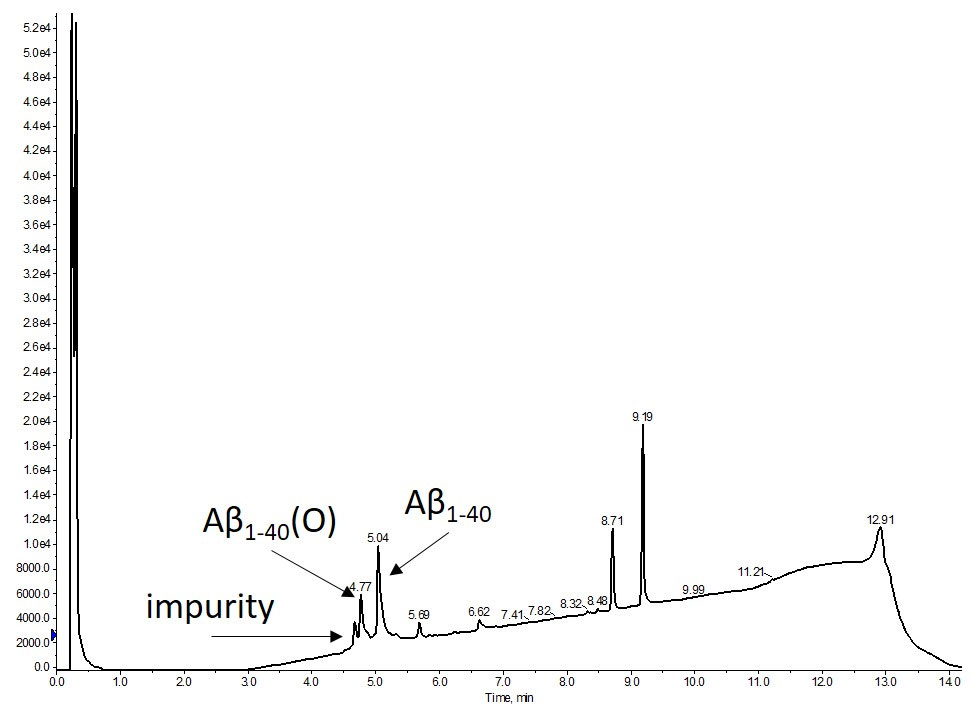
図1: DMSOに溶解した合成アミロイドβ1-40 の粗分析用HPLCの結果。主な生成物は、メチオニンの酸化ペプチド(O)を含むかなりのピークで目的のペプチドが得られました。合成中または樹脂からの切り出し中に発生するメチオニンの酸化を最小限に抑えるための予防措置がとられていない条件で実施しています。
幸運だったのでは、精製した β アミロイドを溶液中で単量体ペプチドを形成するための再可溶化に関するガイドラインがいくつか発表されています。私は、既存技術の再開発を試みるよりも、報告されているガイドラインに従って粗ペプチドサンプルを可溶化することにしました。今回の実験では、DMSO と塩基性 pH の水溶液を用いた 2つの戦略を評価することにしました。
可溶化について重要なファクターは、移動相の添加剤です。完全にモノマー化・可溶化されたペプチドがカラムに到達してもすぐに凝集してしまうのでは、精製の意味がありません。TFA を添加した溶媒は、ペプチド精製に最もよく使われる条件なので、少し試してみましたが、結果は少し奇妙で一貫性がありませんでした(データは記載しません)。そこで、ガイドラインでペプチドを塩基性水溶液に溶解することを推奨していましたので、実のある実験を行うために、移動相添加剤を 0.1% NH4 OH に変更することにしました。
私はグラジエントを少し最適化を行い、フォーカスグラジエントから始め、最終的にはクロマトグラムに存在する 3つの主要なピークをそれぞれ完全に分離するためにはステップグラジエントになりました。その後、粗ペプチド 100 mg を 500 μL の DMSO に溶解し、ステップグラジェントを用いて精製を行いました(図2)。
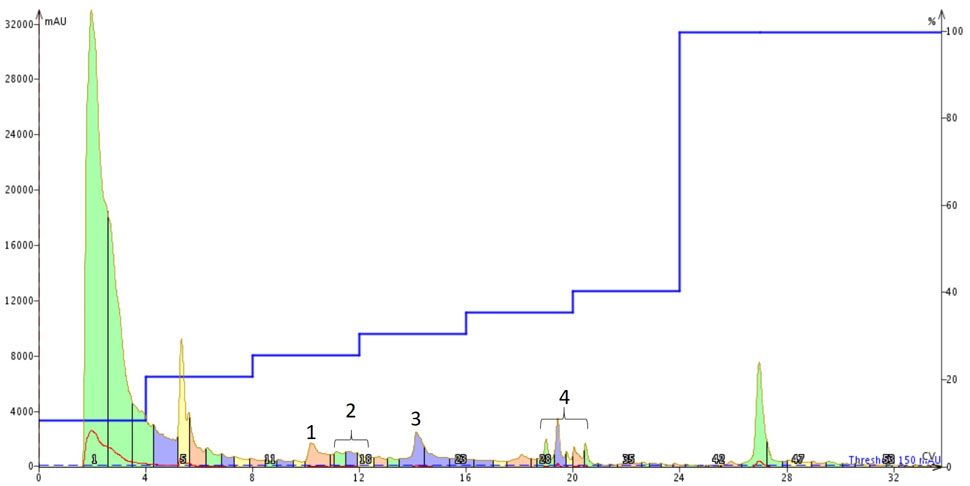
図 2: DMSO に溶解した アミロイ ドβ1-40 の精製には、Sfar Bio C18 カラムを Isolera™ Dalton 2000 システムに接続し、ある程度最適化したステップグラジェントを使用しました。標識された 4つのピークは、特定のペプチド含有量についてさらに分析を行いました。
このクロマトグラムには、正直言って少し驚きました。注入した DMSO 溶液は完全に透明で、凝集物がないことが示唆されました。しかし、ピークの形や数からすると、そうではないようです。そこで、得られたピークを濃縮し、それぞれの標識ピークの相対的な純度を調べてみることにしました(図3)。
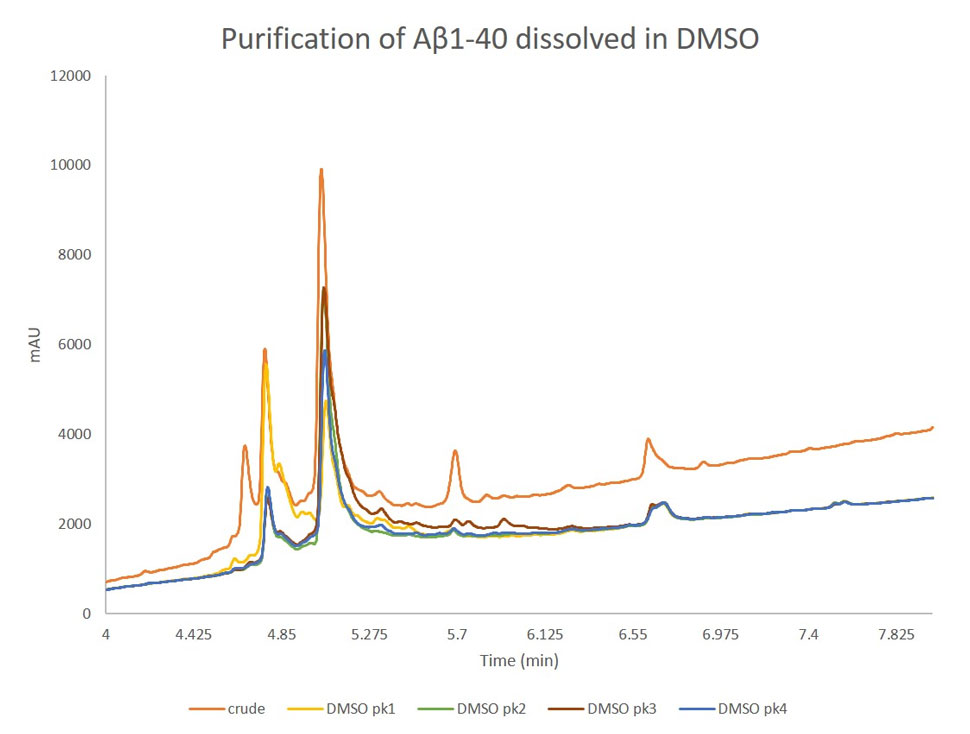
図 3: ピーク1、ピーク2、ピーク3、ピーク4から採取した濃縮サンプルの分析用 HPLC と粗製ペプチドの重ね合わせた結果。ピーク1には予想通り酸化物が多く含まれ、他の 3つのピークには目的のペプチドの濃度が減少していた。興味深いことに、ピーク2とピーク3の分析用 HPLC は、ほぼ同じ組成でした。
興味深いことに、すべてのピークに酸化ペプチドと目的のペプチドが、相対的な濃度が異なるだけで、両方含まれていました。酸化ペプチドの存在は、2つの異なる問題の結果である可能性があります。
精製時の分解能が悪いこと
精製終了後の切り出し操作で目的のペプチドが酸化された
精製時に酸化ペプチドと目的ペプチドが凝集すること
特にピーク2とピーク3では、酸化ペプチド:目的ペプチドの相対比(ox:pdt)はほぼ同じで、ピーク3のサンプルで生成物のピーク幅がより広いことが最も大きな違いです。微妙な差ではありますが、この要因は見過ごせません。この2つのサンプルは、分析組成が似ているにもかかわらず、初期精製時のクロマトグラフィーでの挙動(特にピーク2)が非常に異なっています。このクロマトグラフィーの違いから、この2つのサンプルはコンフォメーションまたはオリゴマー化の違いが生じている可能性が高いことが示唆されました。しかし、このコンフォメーションの違いが何であるかは、現在のところ確認できていません。
私は通常、粗ペプチドをエーテル沈殿させないので、2回目の精製では、溶解する溶媒の一部にアセトニトリルを加えることにしました。その結果、乾燥した固体の中に側鎖保護基が残ってしまい、水に対する溶液の溶解度が大幅に低下してしまいました。さらに悪いことに、この条件ではサンプルはほとんどすぐにゲル化(初期凝集とおそらく繊維化)し始めました。同じ量の粗ペプチドを今度は25% MeCN(aq) + 1% NH4OHに溶解し、同じステップグラジェントを用いて精製すると、全く異なるクロマトグラフィー挙動が見られました(図4)。
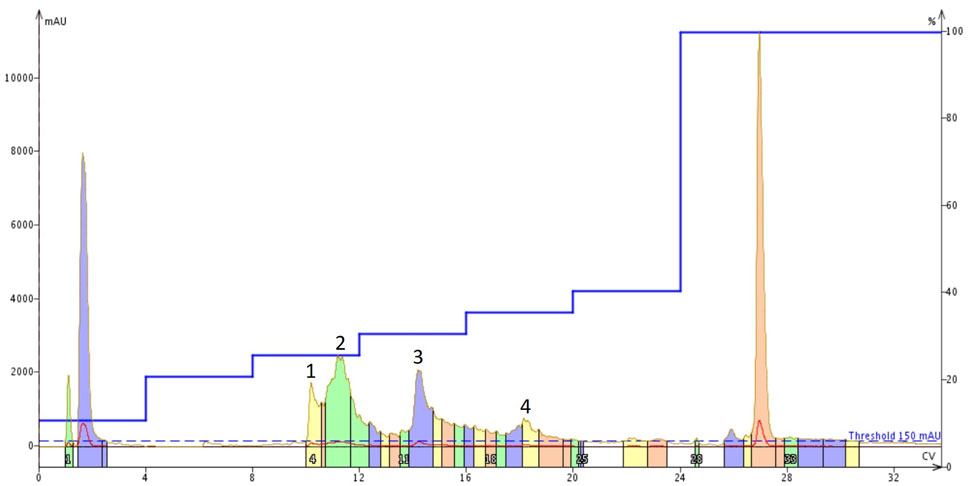
図 4: アミロイド β1-40を25% MeCN(aq) +1% NH4OH 溶液に溶解した精製は、Isolera™ Dalton 2000 システムに接続した Sfar Bio C18 カラムを用い、最適化したステップグラジェントで行いました。標識された 4つのピークは、特異的なペプチド含量についてさらに分析しました。
前回実施した精製と同様、やはり当初の予想よりも多くのピークが見られました。しかし、すぐに凝集(ゲル化)したことを考えると、これはあまり驚くことではありません。重要なことは、一般的にピークの形状が大幅に改善されていることです。これは、溶液中に存在するコンフォメーションの不一致が少なく、全体的な精製効率が向上していると思われます。4つの標識ピークをさらに分析しました(図5)。
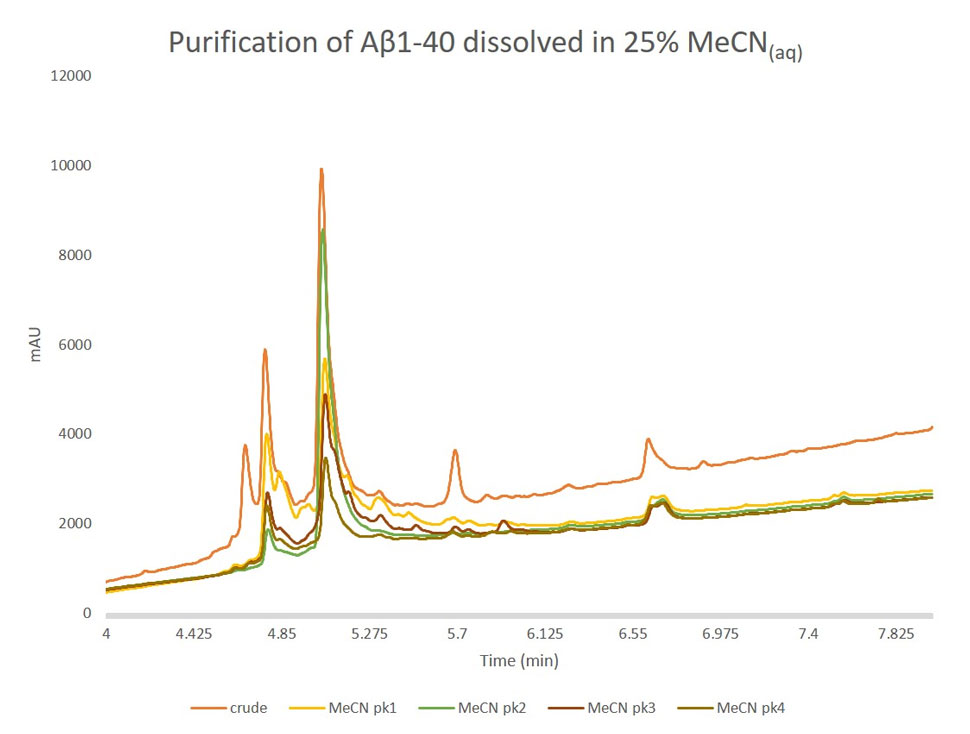
図 5: ピーク1、ピーク2、ピーク3、ピーク4から採取した濃縮サンプルの分析用 HPLC を粗ペプチドと重ね合わせた結果。ピーク1には、予想通り、酸化物のペプチドが含まれています。重要なことは、ピーク2には目的のペプチドが多く含まれ、酸化生成物はごく一部であることです。残りの2つのピークも、酸化物と目的物の混合物ですが、相対的な濃度は増加していました。これらの比率の増加やクロマトグラフィーの保持の違いから、ピーク3および4は目的のペプチドのオリゴマー化状態の違いであると推察します。
精製結果が改善されてよかったです! この結果は、粗分析のクロマトグラムから予想されるものと一致しており、より良く見えます。ピーク1には、酸化ペプチドと目的ペプチドの両方がかなりの量含まれていますが、ピーク2が実質的に目的生成物であることがわかりました。これらの結果から、塩基性溶媒条件は、DMSO 溶媒のサンプル溶液よりも確実に高い精製効率をもたらすことがわかりました。
最後に、粗ペプチドサンプル 100 mg程 を 1% NH4OH(aq) に溶解し、精製することにしました(図6)。これらの条件は、緩衝液に比較的素早く希釈することで、あらかじめ形成された凝集体を形成しにくくするだけでなく、溶液中のモノマー状態を維持するのに最も効果的であることが実証されています。
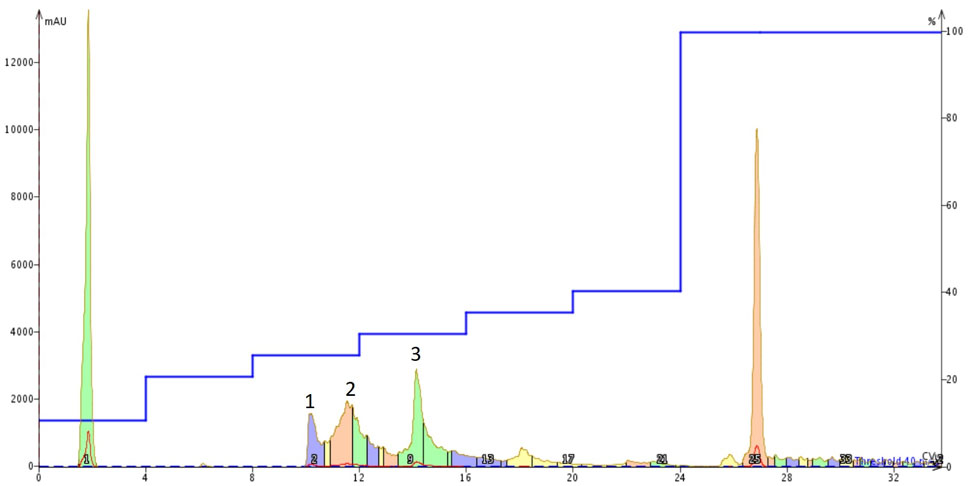
図 6: アミロイド β1-40 を 1% NH4OH(aq)溶液に溶解し、Sfar Bio C18 カラムを Isolera™ Dalton 2000 システムに接続し、最適化したステップグラジェントを用いて精製しました。標識された3つのピークは、特定のペプチド含量についてさらに分析しました。
この精製条件は、ベストと考えています。ピーク形状や分解能は、前回の精製よりもさらに向上しています。精製開始前に溶解したサンプルに少量の濁りがありましたが、分離に大きな影響を与えることはありませんでした。このピークは、他の2つの精製と比較して、最も少ない量のクロマトグラフィーの「悪い挙動」を示しています。3つのラベル付きピークを濃縮し、分析用 HPLC で評価しました(図7)。
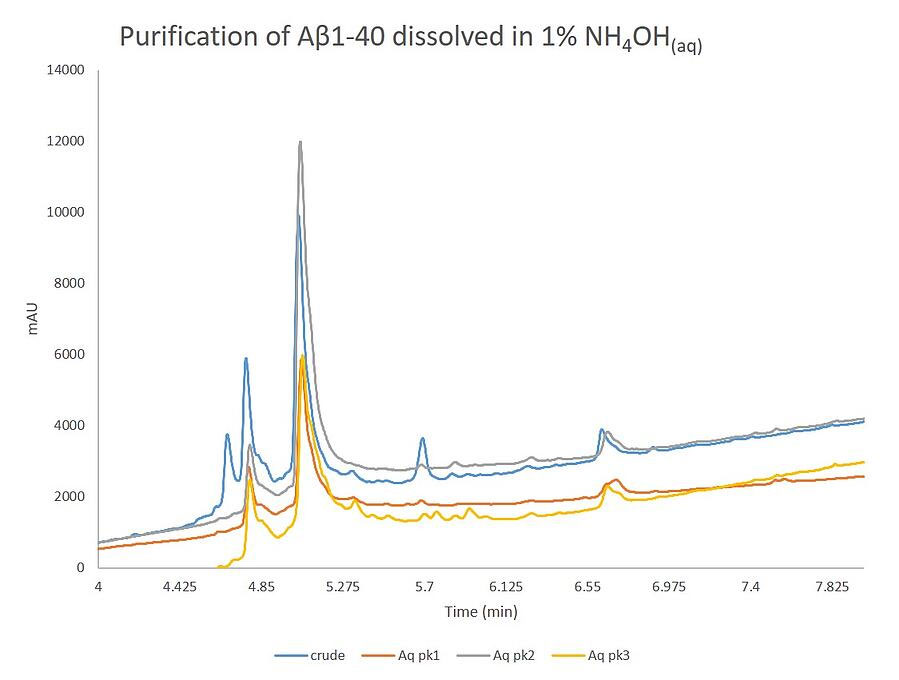
図 7
この分析結果は、実際の精製時に観察されたことを確認しています。興味深いことに、ピーク1とピーク3は、保持に大きな違いがあるにもかかわらず、ほぼ同じ組成を含んでいます。最初のピークは、これまでの精製と同様に、酸化生成物に起因し、目的のペプチドが若干含まれています。重要なことは、目的のペプチドはピーク2に含まれ、今回の投稿で比較した3つのサンプルの中で最も高いレベルの純度と収率を示しました。
精製効率を考える上で、精製前の溶媒条件の選択がいかに重要であるか、このデータでお分かりいただけたかと思います。ほとんどのペプチド合成の研究者にとって、精製はすでにボトルネックになっています。
Googleで数分検索するか、問題のペプチドについて少し考えたり、何度も精製を繰り返したりすることで、収率が悪いために完全に合成し直したりすることをなくすことができるのです。
難しいペプチドをどのように扱ってきましたか?
この他にも、ペプチド精製効率を向上させるための戦略について詳しく知りたい方は、リンク を参照してください。
日本語化:2023年2月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(600KB, 2023年2月)