January 24, 2020
Elizabeth Denton
ペプチドの二次構造を安定化させる戦略としての側鎖を共有結合で架橋したステープリングは、1990年代半ばにMiller、Blackwell、Grubbsによって紹介され、2000 年代前半にSchaffmeister and Verdineによる精力的な研究によって、注目が集まるようになりました。ペプチドの樹脂上で修飾できるプロトコルが開発されましたが、多くの場合、これらのメタセシス反応は手作業で、しかも室温で行われていました。
本日の投稿では、マイクロウェーブ加熱を用いてオレフィンメタセシスを反応効率を落とすことなく促進させ、合成全体を自動化することを目的として異なる反応条件を比較しました。
タンパク質―タンパク質相互作用(PPI)やそれに関連する生物学的な反応経路を研究するツールとしてペプチドを使用することは、特に手元に構造データがある場合には理にかなっています。2つのタンパク質は、ペプチドと組み合わさることによって自然な構造へ構成されます。しかし、残念なことに、多くのペプチド断片は、無傷のタンパク質から切り離されると、二次構造を失い、その結果、標的タンパク質への親和性も失われてしまいます。
目的の二次構造、特にヘリックス構造を安定化させるための戦略は研究されており、数多く発表されています。炭素二重結合によるステープリングは、直鎖ペプチド配列に非天然の共有結合の架橋を形成するために2つの適切にマッチしたそれぞれ末端にアルケンを持つ非天然アミノ酸を反応させることができます。
Grubbs によって開拓され、さらにVerdineらによってペプチドに応用されたオレフィンメタセシス反応は、非常に堅牢ですが、通常、自動合成装置を用いて直鎖ペプチドの合成を行った後、手動で実施します。メタセシスを含む完全自動合成への第一歩として、私は BIM ステープルドペプチド から始めることにし、マイクロウェーブ加熱を利用したメタセシス反応条件をいくつか検討しました。
私はまず、直鎖状の天然 BIM 配列を合成しました。主に、私が選択した基本的な合成戦略によって高純度のペプチドが得られることを確認しました。これは N 末端の Fmoc 保護基をそのまま残すためことを確認するためです。合成の確認後、同じ戦略を用いて合成を行いました。今回は発表されているように9位と13位に2つのオレフィン含有アミノ酸を組み込んだ配列を合成し、目的のペプチドを合成できました(図1)。
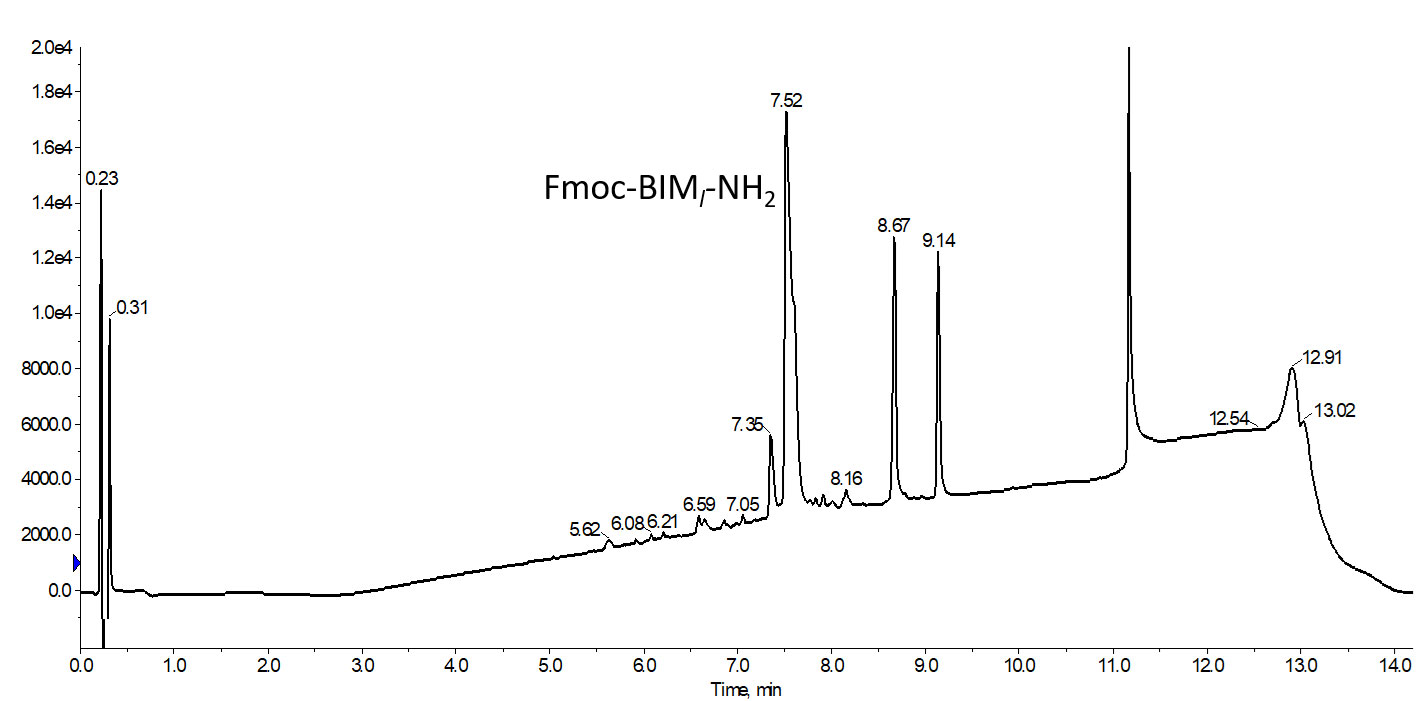
図 1: 閉環メタセシス反応の実施前の非天然の側鎖にオレフィンをもつアミノ酸を 2 つ含んだ粗 BIMペプチドの分析用 HPLC クロマトグラムを示します。2 つの大きく遅い溶出ピーク(それぞれ 8.67 と 9.14)は、残留する保護基に起因するもので、そのマススペクトルを示しています。
私は、このペプチドが実際に期待通りの挙動を示すことを確認するために、論文通りに手作業で最も 標準的なプロトコル から始めることにしました(図 2)。
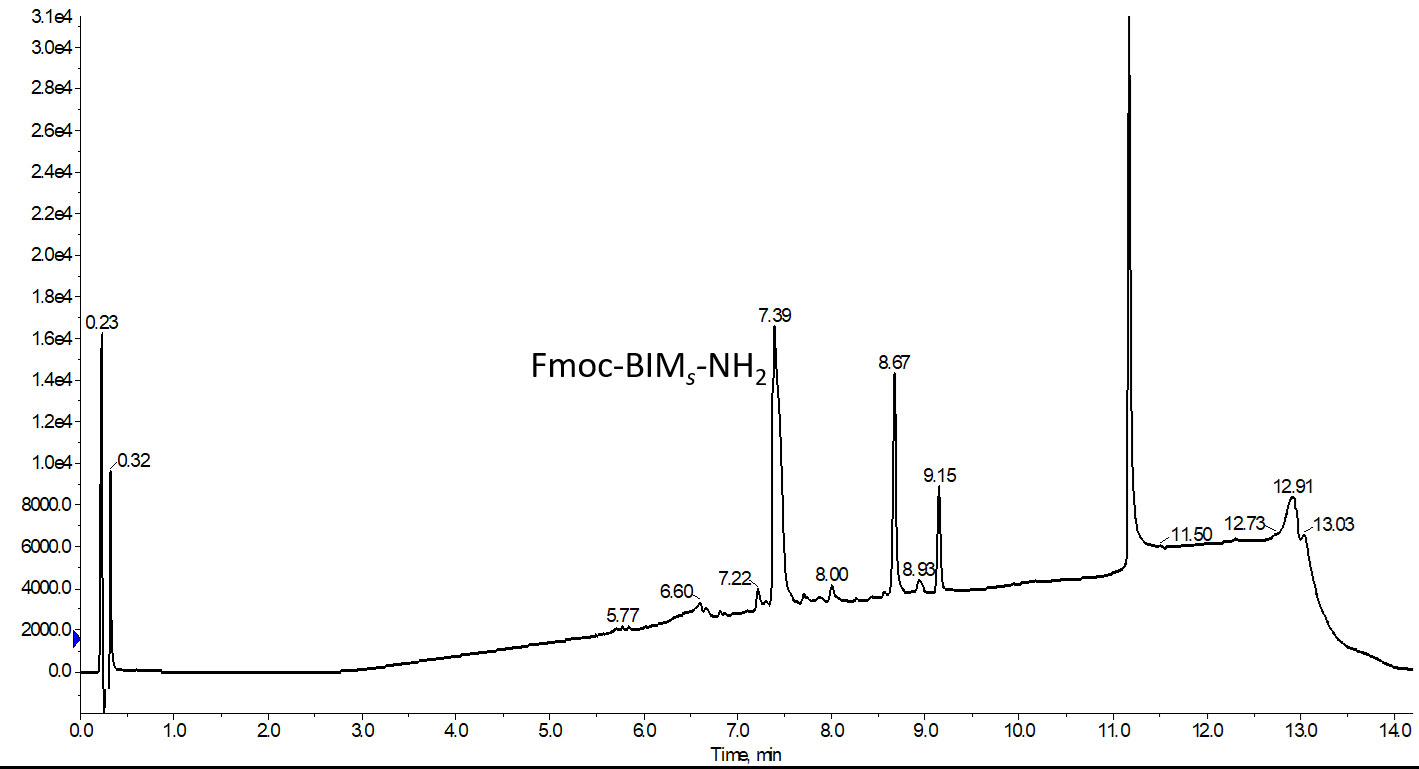
図 2: エレクトロスプレーイオン源(ESI)によるイオン生成の原理。試料イオンは送液する溶媒との溶液中で生成され、キャピラリーを通してイオン源に噴霧され、加熱されたキャリアーガスと電流によって検出コーンに導かれます。イオン源内を移動する間に、キャリア溶媒は蒸発し、検出器に導入される試料イオンのみが残されます。
反応条件に踏み込む前に、懸念される点を挙げておきます。RCM(Ring-closing metathesis)反応に使用する溶媒は 1,2-ジクロロエタンになります。同じハロゲン溶媒であるジクロロメタンよりも沸点は高いが、いずれも非極性溶媒であるため、マイクロウェーブによる加熱が難しい可能性があります。また、温度上昇により、反応中に溶媒が蒸発することも懸念されます。
この反応をマイクロ波で加熱した前例がありますので、そのデータを参考に 40℃で反応させ、Grubbs 触媒溶液を手動で添加し、条件検討を行いました(表 1)。
| 試行 | 反応時間(分) | 反応温度(℃) | 反応回数 | 不活性ガス | 変換率(%) |
|---|---|---|---|---|---|
| 1 | 120 | rt | 2 | Yes | 100 |
| 2 | 30 | 40 | 2 | Yes | 100 |
| 3 | 30 | 40 | 2 | No | 100 |
| 4 | 30 | 40 | 1 | Yes | 95.0 |
| 5 | 30 | 40 | 1 | No | 78.5 |
| 6 | 60 | 40 | 1 | Yes | 99 |
| 7 | 60 | 40 | 1 | No | 96.8 |
表1: 直鎖状ペプチド配列を目的のステープル状ペプチドへ変換するための閉環メタセシス反応条件を示します。
メタセシス反応を 2 回に分けて繰り返して使用する条件が成功したことは、私にとって驚くべきことではありません。RCM は、適切に行われれば、通常、非常に効率の高い反応です。しかし、嬉しい驚きだったのは、不活性雰囲気でなくても、加熱条件で 1 回の反応をいかに効率よく行えるかということです。
DCE 溶液はマイクロウェーブエネルギーをよく吸収し、今回検討した反応で容易に加熱できたことは重要な点になります。また、私が使用した開放系の反応容器では、60 分間加熱した後でも、著しい蒸発は観察されませんでした。これは、この条件が様々なステープル化ペプチドに有効であることを確信させました。
Biotage® Initator+ Alstra™ は一般的な操作に不活性ガスは必要ありませんが、装置に不活性ガスマニホールドを装備することができ、アミノ酸や試薬溶液を保護するだけでなく、反応中にマイクロウェーブキャビティをパージすることも可能となっています。マイクロウェーブ加熱を不活性ガス(この場合は窒素)でパージした場合と、しない場合の反応条件を比較すると、変換効率に違いがあるのは興味深いです(図 3)。
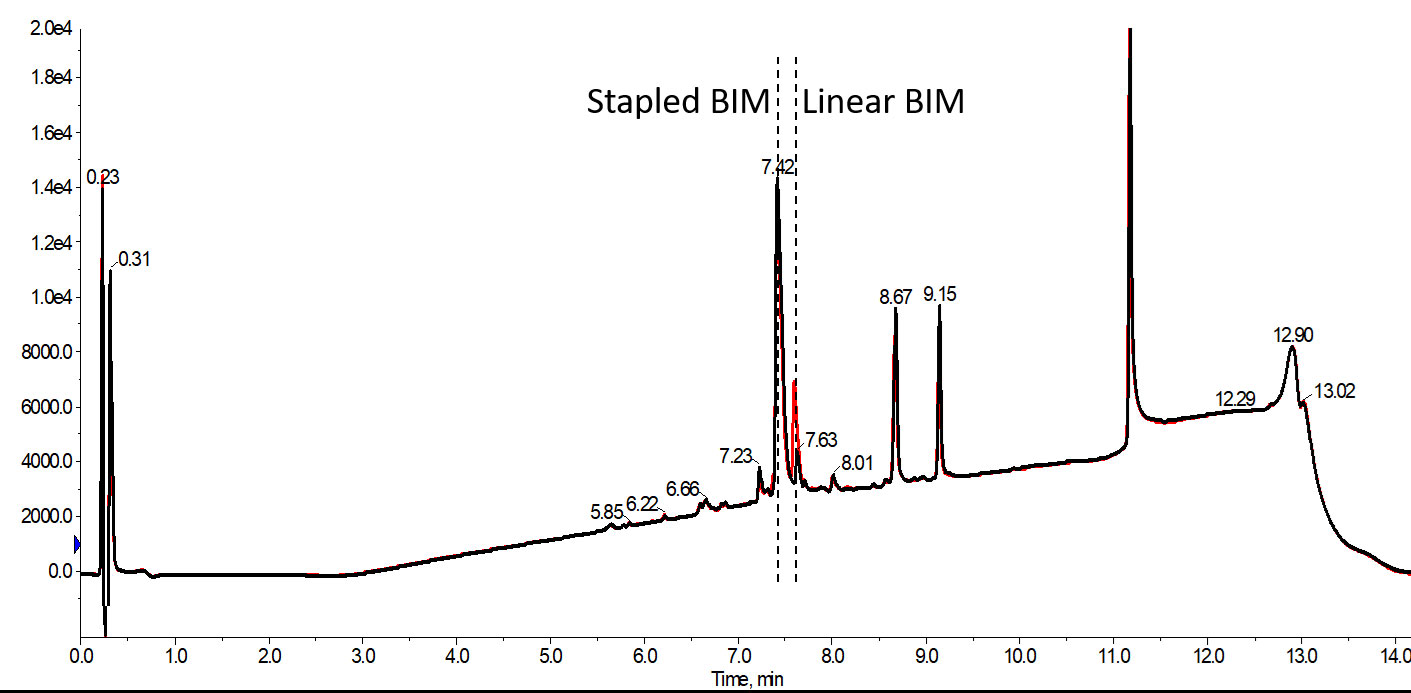
図 3: 反応中にマイクロウェーブキャビティを不活性ガスでパージした(黒)またはしない(赤)RCM 反応を 1 回だけ実施して、40℃で 30 分間ステープリングしたペプチドの分析用 HPLC クロマトグラムを示します。目的の環化した BIM ペプチドの収率は、空気中で実施するだけで 78%に減少します。この違いは、60 分間の単一の RCM 反応でも観察されますが、その割合はより小さくなっています。
この違いには、2 つの可能性が示唆されます。
- Grubbs 触媒は、空気中にさらされることで劣化していきます。第一世代の触媒が空気中の酸素にやや敏感であることはよく知られています。
- 標準的な反応プロトコルで樹脂と溶液を混合するために使用される窒素バブリングは、副生成物のエチレンを追い出し、メタセシス反応をさらに促進させます。
現時点での私の推測では、この 2 つの現象が複合的に作用した結果ではないかと考えています。
今後、第 2 世代触媒を使った条件で、最初の違いについて試してみようと思っています。
閉環メタセシス反応をどのように最適化しました?
ペプチド精製で高純度ペプチドを実現する方法に興味がありますか?