September 1, 2020
Elizabeth Denton
時々、”私の固相ペプチド合成にはどの溶媒がお勧めですか?”という質問を耳にします。歴史的には、アミノ酸の活性化およびカップリング反応の速度論がはるかに有利であったため、ジクロロメタン(DCM)が固相ペプチド合成の溶媒として使用されていました。しかし、現在主に使用されている Fmoc 保護アミノ酸に対する溶解性に難があるため、DCM は反応速度の有用性はありながら、使用されなくなりました。現在では、室温とマイクロウェーブ加熱による固相ペプチド合成の両方で、DMF と NMP が主要な溶媒となっています。しかし、どちらが優れているかという疑問は残ります。
以前の記事では、樹脂の選択 がペプチド合成の結果にどのような影響を与えるか、特に 疎水性の高い配列 の合成について紹介しました。しかし、溶媒が異なれば、樹脂と伸長したペプチド鎖の溶媒和が異なることを考えると、合成時に選択する溶媒も選択する必要があります。
今回の投稿では、疎水性ペプチドの合成をより成功させるために、DMF と NMP で実施されたものを比較していきます。
特定の溶媒が圧倒的に優れているというのは、不公平だと考えることがあります。それぞれの溶媒には長所と短所があります。まず、溶媒の極性の違いについて説明します。DMF は NMP よりもわずかに極性が高く、カップリング試薬溶液を高濃度で調製するときによく使用されます。また、疎水性ペプチドを合成する際にも、この溶解性の高さは顕著に現れます。NMP を疎水性ペプチドの合成に用いると、ペプチド鎖を伸長したとき凝集や沈殿を緩和でき、最終的に全体の粗収量と純度を高めることができます。
一般的に、凝集などは長いペプチド配列で観察されますが、私は 9 アミノ酸という短い疎水性配列で凝集や樹脂の沈殿を経験したことがあります。今回調査するペプチドは、たった 7 アミノ酸ですが、Ile 残基が豊富なため、GRAVY 値は 1.157 となりました。これは、今まで合成したペプチドの中で、最も疎水性の高いペプチドになりました。
私はまず、DMF を溶媒として用いて 7 残基のペプチドを合成しました。すべてのアミノ酸とカップリング試薬は DMF に溶解し、Fmoc 脱保護とカップリングのステップ後の洗浄も DMF で行いました(図 1)。カップリング試薬には DIC と Oxyma を選び、75˚C、5 分間でシングルカップリングで合成を進めました。この配列には 2 つの His 残基があり、これらは側鎖のラセミ化を避けるために 50 ˚C でカップリングさせました。
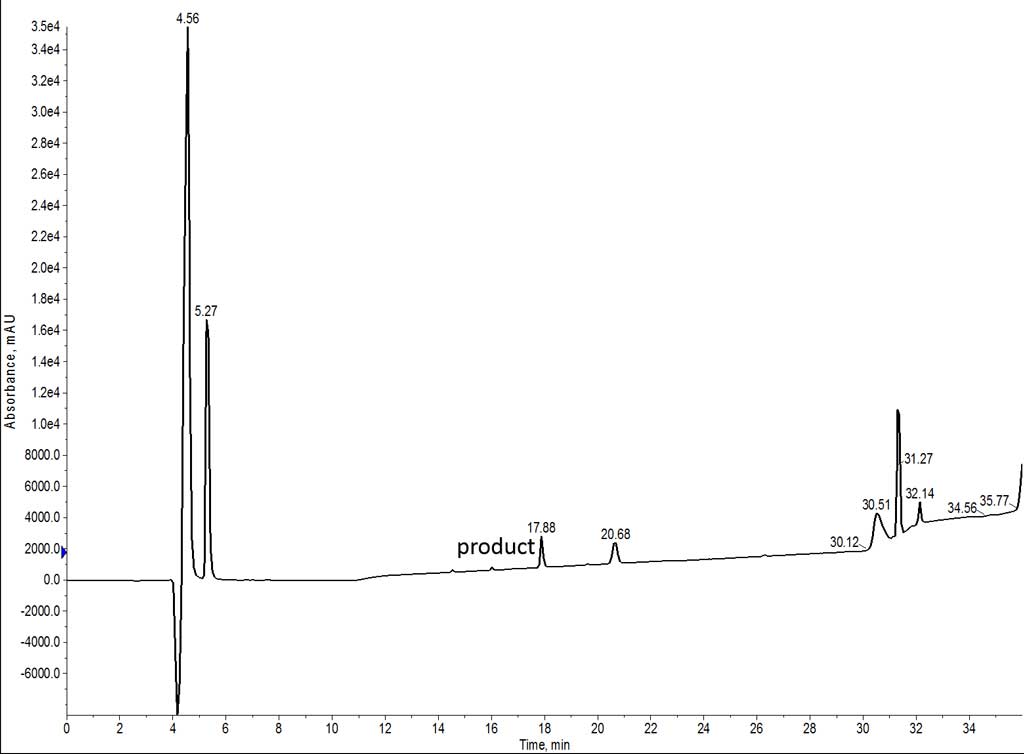
図 1: DMF で合成された 7 アミノ酸ペプチドの分析 HPLC。このペプチドは非常に疎水性が高いため、C4 カラムを用いて分析を行いました。
残念ながら、このペプチドの UV シグナルは非常に弱く検出され、その主な原因はペプチドの不溶性に起因していました。HPLC グレードの水にクリベージカクテルのペプチド溶液を数滴落とすと、雪嵐のような沈殿が生じました。この状況はどのような種類のクロマトグラフィーにも良い条件とは言えません。幸いなことに、His 残基の存在によって低い pH でも安定なプロトン化が可能となり、質量分析で強いシグナルが得られました(図 2)。
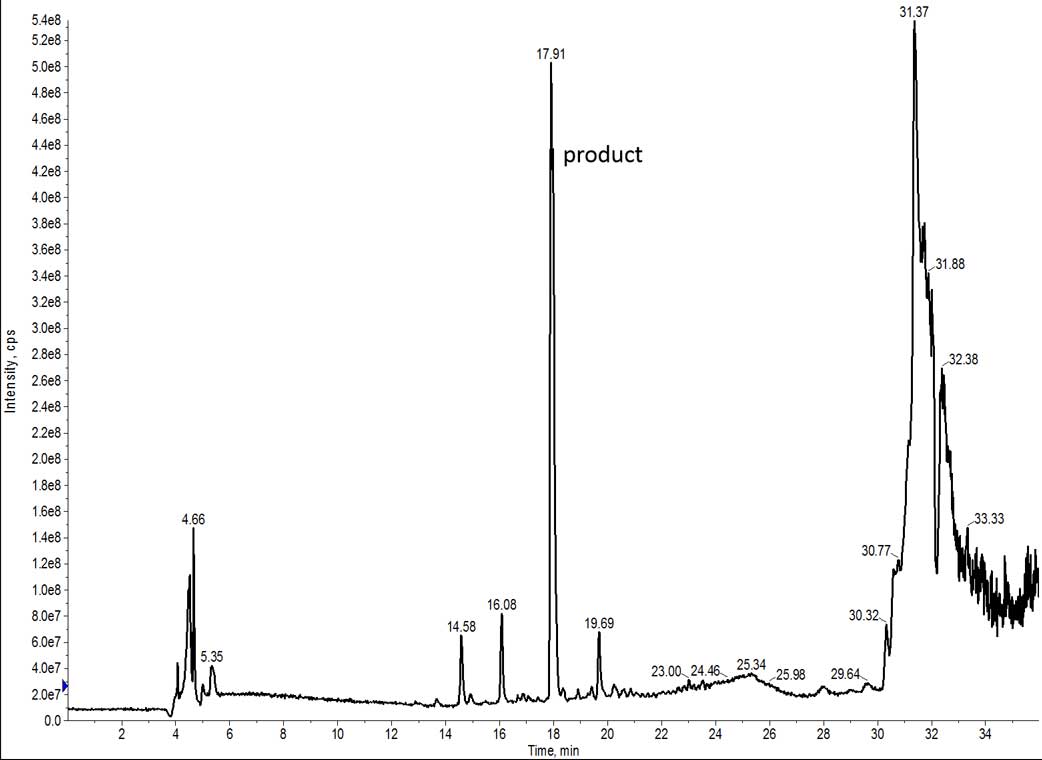
図 2: DMF で合成した 7 アミノ酸ペプチドの TIC。目的のペプチドは一番大きなピークに含まれています。
幸いなことは続き、質量分析は UV よりもはるかに感度が高く、特に欠損ペプチドペプチドの副生成物に対しても、その感度は抜群です。ペプチドの定量には決して TIC を使うべきではありませんが、純度の定性的な比較のために TIC を使っています。目的のピークが実際にはマススペクトルの主要なピークであることがわかりますが、多数のイオンがグラジエント全体に鋭いピークとして検出していることも確認できます。これらのピークは、分子量 500 Da 以上の欠損ペプチドと推測されます。
このデータをもとに、7 アミノ酸ペプチドの合成を繰り返しました。次は主溶媒として NMP を使用した合成の結果を示しました(図 3)。DMF と同様に、アミノ酸とカップリング試薬を NMP に溶解し、洗浄も NMP で行いました。すべて NMP を使用することで、溶媒の混合による樹脂の膨潤性の変化を防ぐことができます。
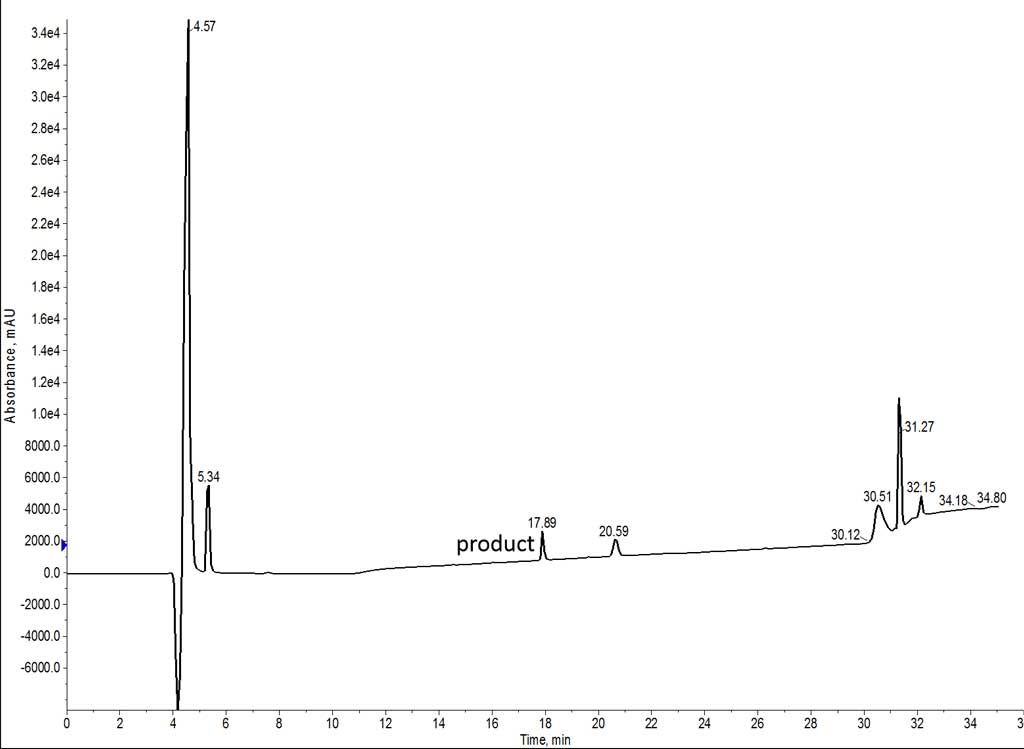
図 3: NMP を主溶媒として合成された 7 アミノ酸ペプチドの分析 HPLC。このサンプルは、非常に疎水性が高いため、C4 カラムを用いて分析を行いました。
DMF 使用時に見たように、このペプチドの UV シグナルは驚くほど弱いです。各サンプルの注入ピークを比較すると、ローディングレベルは非常に似ているように見えます。UV スペクトルの差はそれほど大きくはありませんが、NMP で合成した方がきれいな HPLC クロマトグラムが得られました。もっと強いシグナルが欲しいところですが、このペプチドの溶解性の低さを考えると、これ以上高濃度の溶液を使うことはできませんでした。
DMF と同様に質量分析の結果を確認しました(図 4)。 DMF で合成したペプチドよりも、NMPで合成した方が存在するイオンの数が少ないことがすぐにわかります。これは、このサンプルが DMFで合成したサンプルよりも純度が高いことを示唆しています。
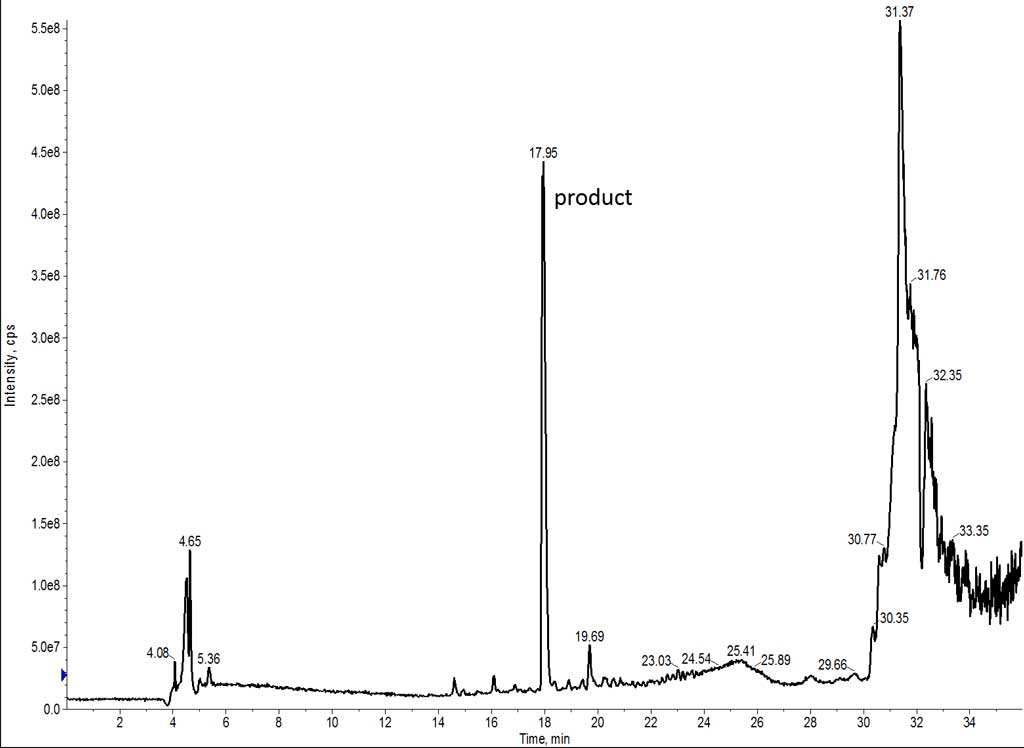
図 4: NMP を主溶媒として合成した粗製 7 アミノ酸ペプチドの TIC。一番大きなピークに目的のペプチドが含まれています。
ペプチド鎖が短いにもかかわらず、疎水性が非常に高いため、効率的な合成ができないことがあります。NMP と DMF で合成したペプチドと比較すると、NMP は極性が低く、伸長中のペプチドの溶解性を維持していると推測されるため、合成の純度が向上しました。この結果は、より長いペプチドの合成に対して相関した結果が観測されています。
ペプチド合成の際に、DMF ではなく NMP を選択するのはどのような場合ですか?
ペプチド精製の効率化について、ご興味がおありですか? 詳しく知るには、リンク を参照してください。
日本語化:2022年6月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(2022年6月, 410KB)