October 29, 2020
Elizabeth Denton
新しい技術に挑戦してみたものの、結果が出ずに挫折してしまった経験はありませんか? また、その悔しさをバネに、何かいい方法はないかと探してみたものの、結局手つかずで終わってしまったという経験はありませんか?私もそういった経験があります! そして、多くの場合、努力の甲斐なく、それが効率的であろうとなかろうと、元の方法に戻ってしまいます。これはどんな場面においておきることがあるでしょう。
私はフラッシュクロマトグラフィーでペプチドを精製するようになって数年経ちますが、正直なところ、同じような経験をしたことが何度かあります。しかし、私はあきらめることなく前進し、他の研究者の助けを借りて、この技術をより簡単にするための戦略をいくつか発見することができました。
今回の投稿では、フラッシュクロマトグラフィーによるペプチド精製をより成功させるために、最も有用な方法をヒントとコツをまとめました。
新しい技術を習得したり、古い技術を新しい用途に応用したりする際には乗り越えなければならないハードルがあります。これらを成功するためには考え方を変えたり、方針を変更したりすることが必要になります。これは、従来は低分子化合物精製のためのツールであったフラッシュクロマトグラフィーをペプチドの精製へ適用する場合にも当てはまります。ペプチドを精製する場合、純度に対する要求は確かに高くなることが多いですが、だからといって、ペプチドの分野においてフラッシュ精製の可能性が直ちになくなるわけではありません。ここでは、フラッシュクロマトグラフィーによるペプチドの精製を成功させるために私が実践している 5 つのコツを紹介します。
必ず粗ペプチドを分析用 HPLC で測定してください
これにはいくつかの理由がありますが、最も重要なのは簡単な HPLC 分析から得られるグラジエント情報であり、実際にフラッシュ精製を行うとき、このときのグラジエント設計を反映することが多いからです。他の理由として、あまり議論されていない重要な特徴は、分析用 C18 カラムでのペプチドを溶出するために必要なアセトニトリル濃度は、フラッシュ C18 カラムに切り替えても変わらないということです。
サンプルの溶出条件を補完するグラジエントの設計
ペプチドを溶出するのに必要なアセトントリルの濃度が決まれば、グラジエントを設計することができます。精製 初心者 の場合、この作業は精製準備の中で最も困難な作業となります。なぜなら、HPLC を使用した精製を改善するために活用する方法が、ここでは役に立たないからです。私は通常、サンプルをインジェクションするときの濃度は、溶出濃度より 15-20% 低いアセトニトリル濃度から始め、10 カラムボリュームで直線的に約 50% 増加するように設定し、最後に一気に 100% アセトニトリル濃度へステップアップしてカラム内を洗浄するようなグラジエントを設計しています(図 1)。この設計方法は、ほとんどのペプチドサンプルでうまく機能しました。
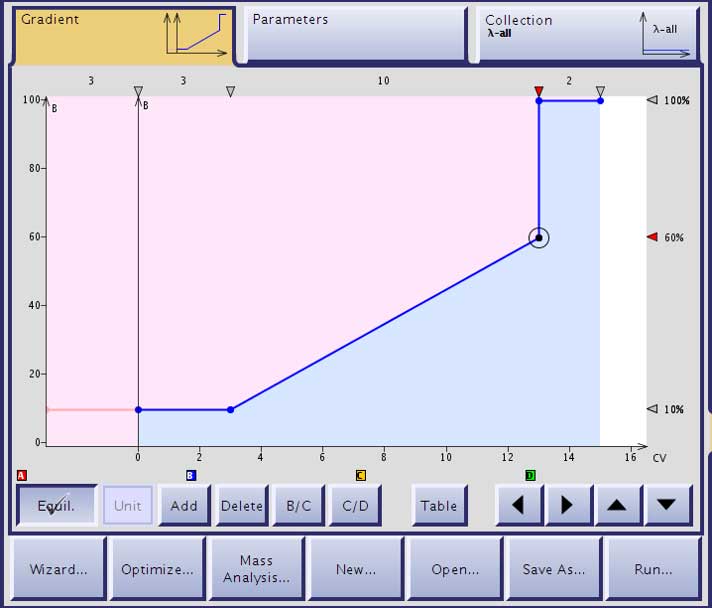
図 1: 分析用 HPLC で測定されたアセトニトリル 25-30% 濃度でサンプルが溶出する条件で設計したフラッシュでペプチドを精製するためのグラジエント。カラムを 10%アセトニトリルで平衡化(左のピンク)、サンプルをカラムにロード(縦線)、サンプルインジェクションの溶媒を完全に除去するためにカラム内のアセトニトリル 10% 濃度に維持し、10 カラムボリュームで 60% までアセトニトリルを増加するリニアグラジエントで精製します。
移動相添加剤を 高濃度 で使用する
通常、移動相は合成した租サンプル中のペプチドの分離を向上させるため、約 0.1% 濃度の酸(TFA またはギ酸)を添加します。しかし、フラッシュカラムで精製できるサンプ量を考慮すると、インジェクションしたすべての成分が想定通り完全にプロトン化させるために、添加剤の濃度を上げる必要があるかもしれません。移動相の添加剤濃度を TFA0.1% から 0.5% 濃度(または他の添加剤でも可)に上げると、クロマトグラムが著しくシャープになることがわかりました(図 2)。ピークがシャープになることで、目的サンプルの取得や分析も容易になります。
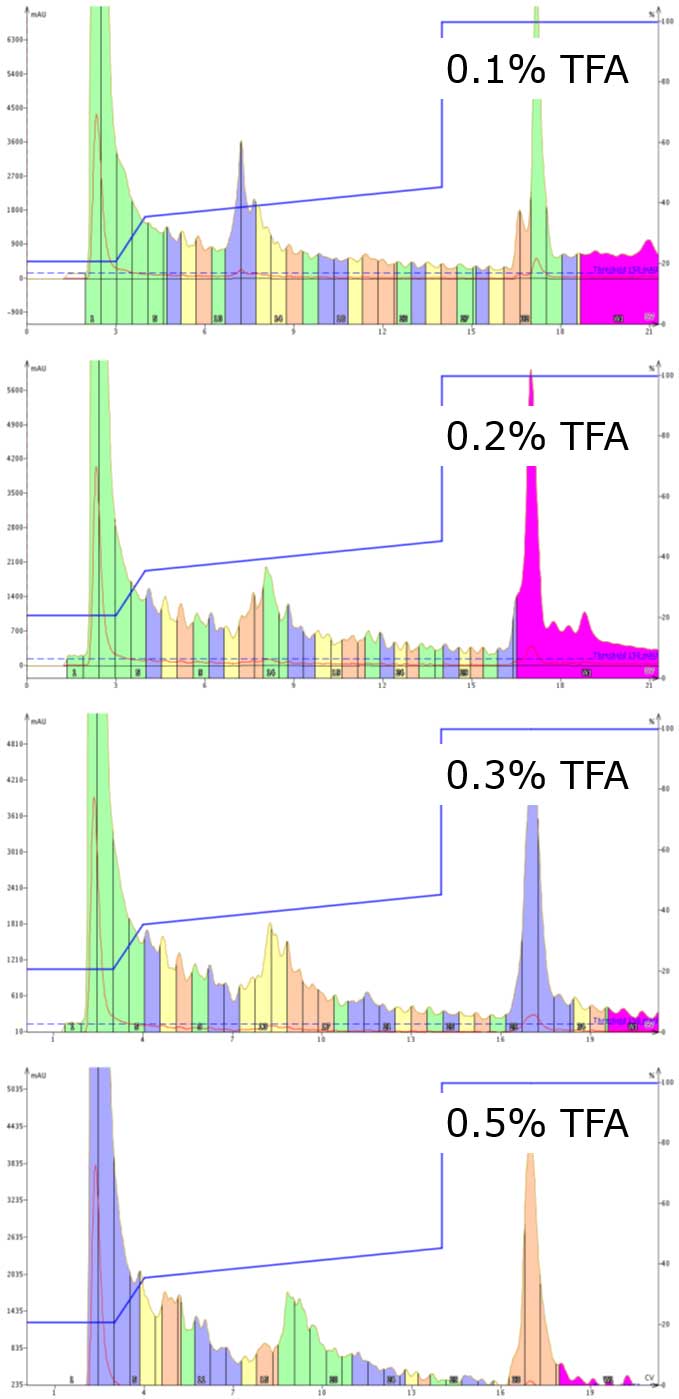
図 2: 移動相の TFA 濃度を上げながら 37 アミノ酸のペプチドを精製したクロマトグラム。TFA 濃度を上げるとピークが著しくシャープになり、最も純度の高いフラクションを選択する確率が上がり、追加で精製する必要がなくなります。
サンプルをできるだけ少量ずつカラムにインジェクションします
逆相クロマトグラフィーを行う場合(どのタイプでも)、順相クロマトグラフィーを行う場合よりもピーク幅の拡大が懸念されます。これは、サンプルがカラム上にある間に起こるパーティショニングのメカニズムによるものです。ピーク幅を最小化するには、サンプルをできるだけ少量の溶媒に溶解してカラムにロードすることをお勧めします。実際、私は DMSO を使用してサンプルを溶解するこ
とが多いです。DMSO を使用すると、サンプルを高濃度に保つことができ、クロマトグラフィーの結果に影響を与えることがありません。
ペプチドの物理化学的性質を考察する
多くの場合、私たちは初期設定や実績のある設定に頼ることになります。例えば、0.1% TFA を添加剤として使用した条件での HPLC 精製などです。しかし、この条件でうまくいかないことがあります。もし、分析開始前にペプチドの物理化学的特性を考慮すれば、この頭痛の種は完全に回避できるかもしれません。私は通常、ペプチドの等電点を確認し、HPLC と組み合わせて、移動相の pH を酸性
あるいは塩基性にするかを決定し、最良の精製結果を得るようにしています(図 3)。
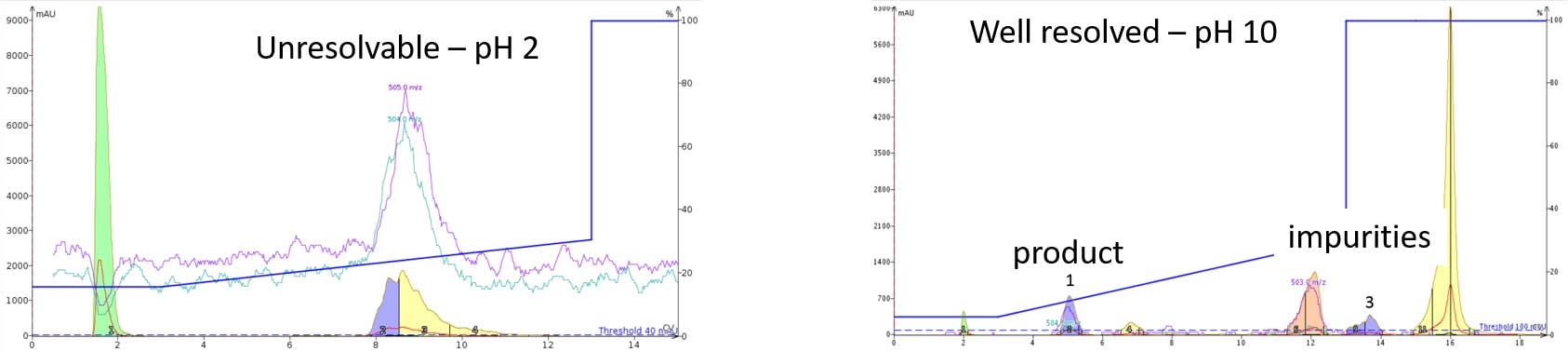
図 3: 移動相の pH 変化のみでの達成した精製効率化。直鎖状と環状のペプチドを含むオキシトシンのサンプルは、pH 2 (0.1% TFA) では分離不可能であったが、pH 10 (0.1% 水酸化アンモニウム) では容易に精製可能に。
これらのヒントを参考に、フラッシュ精製を使ったペプチドサンプルのフラッシュ精製を検討されてはいかがでしょうか?
フラッシュクロマトグラフィーを使って、最終的なペプチドの純度を向上させるテクニックにご興味がおありですか?詳しく知るには、リンク を参照してください。
日本語化:2022年5月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(440KB, 2022年5月)