June 17, 2020
Elizabeth Denton
粗ペプチドを精製する際には、移動相には常に添加剤を用いています。添加剤は、目的のペプチド、およびサンプル中のあらゆる不純物を単一のプロトン化状態に誘導することにより、潜在的に複雑な精製を簡単にすることができます。そうすれば、同じペプチドでもプロトン化の有無によって生じる電荷の異なる多くのペプチドを検出するのではなく、単一のペプチドだけを精製できることになります !
酸性溶液は移動相添加剤として一般的に使用されています。トリフルオロ酢酸(TFA)を選択するグループもあれば、ギ酸(FA)を選択するグループもあります。しかし、他にも考慮すべきものがあるか検討しました。今回の投稿では、移動相添加剤としての酸性緩衝液の効果を探り、これらの精製効率が TFA で実施されたものと比較していきます。
私はすでに、移動相添加物質の重要性を示すいくつかのブログを発表しています。単に 移動相 pH を調整することによって、それが 添加剤濃度 に対するピーク形状の変化であるか、または全体的な純度を改善するかにかかわらず、添加剤の選択は、一般的な精製において重要な役割を果たします。また、移動相添加剤を変更することは、精製方法最適化するための開発において最も検討しやすい略の 1 つになります。
そこで、他の移動相添加剤について考え始めました。私は分析化学者に相談し、溶液の pH を変えることに加え、実際に 移動相を緩衝する ためにギ酸アンモニウムなどが良く使用されていることを発見しました。HPLC と LC/MS の両者に用いられる、標準的な添加剤成分とそれに関連する pH 範囲の一覧を見出しました(表 1)。この表で重要な点はすべての標準的な添加剤が MS と適合しているわけではないことです。なぜなら、これらの緩衝溶液の成分は十分な揮発性を持っていないからです。揮発性がないと、時間の経過とともに MS 機器のイオン信号強度や一般的な機械的安定性が損なわれる可能性があります。MS に新しい変更する前には十分な確認を行ってから使用してください。
| 緩衝溶液 | pH 範囲 | MS 適合性 |
|---|---|---|
| リン酸(pK1) | 1.1 – 3.1 | No |
| リン酸(pK2) | 6.2 – 8.2 | No |
| リン酸(pK3) | 11.3 -13.3 | No |
| 酢酸塩* | 3.8 – 5.8 | Yes |
| クエン酸塩 | 2.1 – 4.1 | No |
| クエン酸塩 | 3.7 – 5.7 | No |
| クエン酸塩 | 4.4 – 6.4 | No |
| TFA(0.1%) | 2.0 | Yes |
| リン酸(0.1%) | 2.0 | No |
| ギ酸(0.1%) | 2.7 | Yes |
| ギ酸アンモニウム(0.1%) | 2.7 – 4.7 | Yes |
| 炭酸水素アンモニウム | 6.6 – 8.6 | Yes |
| ほう酸塩 | 8.3 -10.3 | Yes |
表 1: 逆相 HPLC または LC/MS で一般的に使用される添加剤のリスト
*注-酢酸緩衝溶液は、アンモニウムカチオンと対になっている場合にのみ MS に適合します。
添加剤の一覧で利用可能な選択肢のうち、ギ酸アンモニウムを用いていくつかのペプチド精製を試みることにしました。この添加剤についての素晴らしいことは、私が標準に使用する TFA 添加剤と同じ pH 付近に緩衝能がありますが、私の Biotage® Isolera™ Dalton2000 にも十分に使用できる揮発性があることです。
緩衝溶液の強さは緩衝液の塩濃度に直接比例することが重要になります。高速フラッシュクロマトグラフィー(HPFC)を使用する場合、サンプルの負荷量を大きい条件で実施する可能性を考慮すると、緩衝液濃度は、クロマトグラフィーの結果を明確にする役割につながる可能性があります。そこで私は、BID 誘導体 (18 アミノ酸の配列および pI=7.81)をいくつか分割し、添加剤を加えた移動相として pH3.4 のそれぞれ 10mM、20mM または 50mM ギ酸アンモニウムを用いて精製することにしました(図1)。
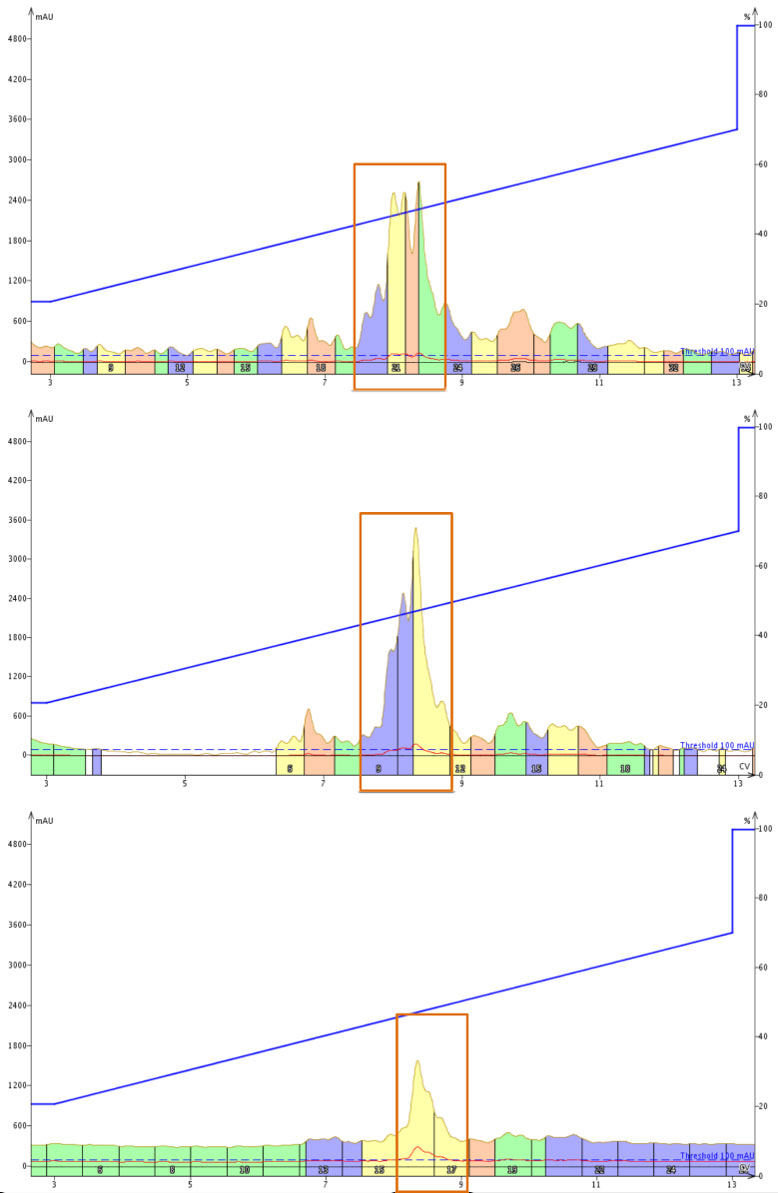
図 1: 移動相添加剤として 10mM ギ酸アンモニウム(上)、20mM ギ酸アンモニウム(中)または 50mM ギ酸アンモニウム(下)かを用いた BID ペプチド誘導体の精製。
まず最も目についたのは、TFA 濃度の増加 に伴って観察されたものと同様に、ピーク形状が明らかに鋭くなったことです。この結果は、TFA 濃度での経験から予想できたものでした。各精製は、粗ペプチド約 40mg を用いて行いました。したがって、欠損ペプチドやメインで得られる目的のペプチドは緩衝溶液により目的配列 18 アミノ酸のうち電荷状態を管理・維持する 8 個の酸性アミノ酸または塩基性アミノ酸を含むことを留意しなければなりません。
興味深いことに、ギ酸アンモニウムによる精製で観察された最も鋭いピークを、TFA を添加剤と用いた精製で観察されたピークと比較すると、TFA を用いたピークよりも明らかにブロードしていました (FWHH で 6mL 対 5mL)。このことは、50mM ギ酸アンモニウムは、pH3.4 で目的のペプチド(または欠損ペプチド)のプロトン化状態を完全に誘導・維持していないことを示唆しています。Asp および Glu 側鎖のカルボン酸の pKa がそれぞれ 3.66 および 4.25 であることを考慮すると、サンプルは精製プロセス中に急速なプロトン交換を受けており、ピーク幅のブロードに寄与している可能性が高くなっていると考えられます。
第二に、ギ酸アンモニウムを添加した移動相では、ペプチドの保持の増加傾向はなさそうです。これは、ギ酸がトリフルオロ酢酸アニオンよりはるかに弱いイオンペアであるため、正電荷の側鎖を遮蔽して見かけ上の疎水性を高めることができないためと思われます。
フラクションのそれぞれを組み合わせて(オレンジ色で囲った部分)、HPLC でクロマトグラムを分析したところ、最終純度においては大きな差はありませんでした(図 2)。
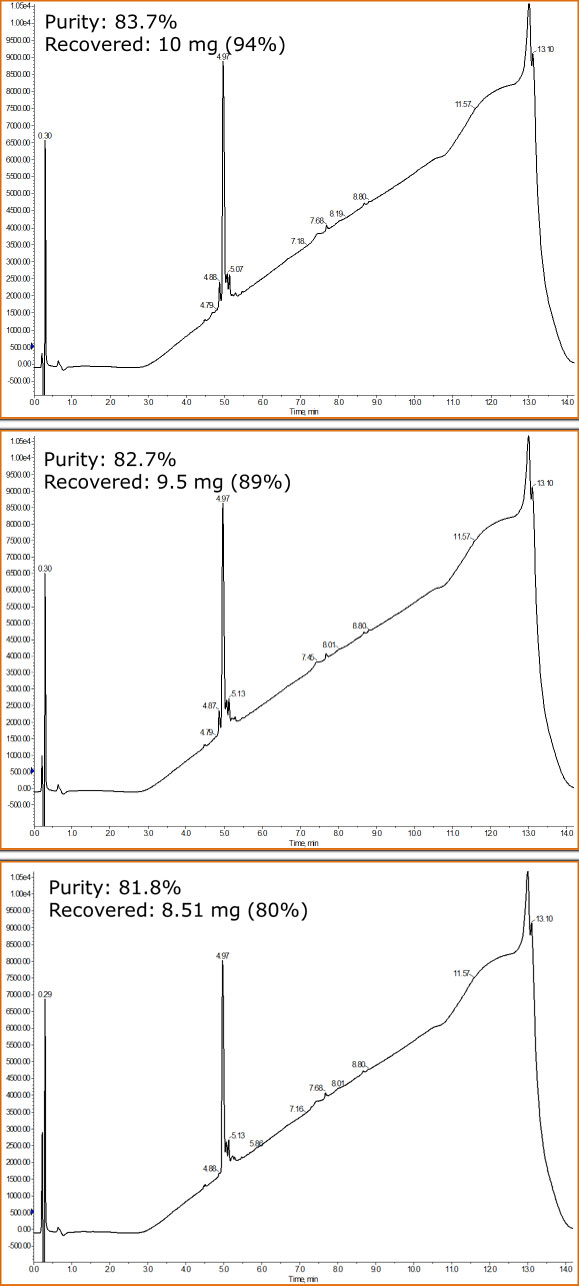
図 2: 10mM(上)、20mM(中)または 50mM(下)ギ酸アンモニウムを添加した移動相を用いて、図 1 中のオレンジ色で囲った部分で示されるクロマトグラムを組み合わせ、BID 精製後の最終純度およびペプチド回収量について分析しました。
ペプチドの相対的な純度は移動相添加剤に対する有意な差はありませんでしたが、精製したペプチドの回収量がわずかに減少していました。これは、目的のペプチドの状況によって、有意になる可能性があります。
私の見解では、ペプチドの純度と回収率のわずかな違いは、HPFC による精製の検討で観察されたピーク形状の改善が影響したと思います。ペプチド精製に HPFC を使用する際に化学者が遭遇する最大の課題の 1 つは、どのフラクションが目的の化合物を含むかを同定することです。私は、10mM のギ酸アンモニウムを使用した精製から最も目的のペプチドを含んだどのピークを正確に選択できるか挑戦したいです。ほとんどの人は、そのような挑戦はしないと思います。このように明確でないことについては、単に添加剤の濃度を上げることで回避できるようなものではなく、フラストレーションや時間を浪費してしまうでしょう。
注意: フラッシュ精製システムでこのタイプの添加剤の濃度検討を試してみると決めた場合は、メーカーに確認してください。高レベルの緩衝塩は、装置の動作に対して影響を与える可能性があります(なぜ私がこのスクリーニングにおいて濃度を 50mM までに限定したのは、このような懸念を持っていたためです)。
日本語化:2022年4月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(470KB, 2022年4月)