June 2, 2020
Elizabeth Denton
固相合成したペプチドの精製は、HPLC とフラッシュによる精製方法に関わらず、ほとんどが移動相に添加剤を使用します。 イオン化可能な側鎖が配列に存在する場合、目的のペプチド(および副生成物)を単一の明確なピークでカラムから溶出させるために、移動相の pH に影響を与える必要があります。
最近は、基本的に 0.1%濃度になるように添加剤を使用することが標準的ですが(精製条件によって異なることはあります)、フラッシュクロマトグラフィーを用いてペプチドを精製する際に、これまでの条件がペプチド配列に存在する官能基をプロトン化するのに本当に十分な添加剤であるかどうかを考えるようになりました。今回のコラムでは、一般的なピークの形状と最終的なサンプルの純度に関して、移動相の添加剤の濃度の違いによる影響を紹介したいと思います。
ペプチド精製に逆相高速フラッシュクロマトグラフィー(RP-HPFC)を使用することの最大の利点の一つは、サンプルを多くローディングできることです。この利点を十分に生かすために、私はよく非常に濃縮されたサンプル(サンプル 100mg 以上/溶媒 100μL 以上)を精製用カートリッジにロードします。(図 1)。
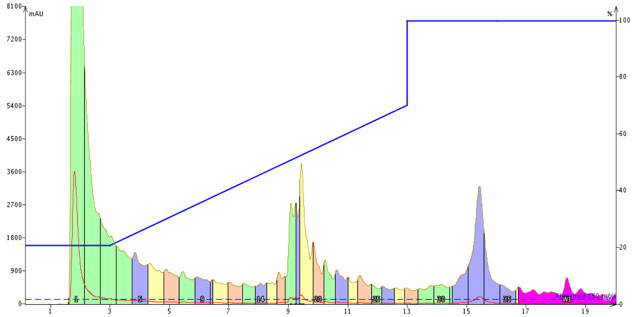
図 1: 標準、初期、勾配および移動相に 0.1%TFA を添加し、標準的な濃度やグラジエントで実施した HPFC による粗 GLP-1 の精製
サンプル約 40mg の粗ペプチドを DMSO 300μL に溶かしてカラムにロードしました。主要ピーク(黄色)には目的のペプチドが含まれていますが、ピーク前後の不純物とうまく分離できませんでした。
私は、ペプチドを効率的に精製するためにフラッシュクロマトグラフィーを用いた時の純度や簡便さを改善できる新しい方法を常に探しています。このフラッシュ精製を初めて使う人からよく聞く悩みは、ピークの幅が広く、どのピークが目的の化合物が対応するかが分かりにくいということです。
同僚と話をしている中で、精製においてペプチドサンプル、カラム、移動相、それぞれがどのような作用が起こっているのかを考えるようになりました。 私は、フラッシュクロマトグラフィーでペプチドを精製する際に、比較的濃縮されたサンプル(ほとんどの場合 50〜100mg)をカラムにロードし、その後、比較的少量の移動相(約 300mL、多くの場合 10〜15 分)でカラムから素早く溶出させています。 移動相への添加剤は、精製されるサンプルが単一のイオン化状態にあることを確認することが目的になりますが、これまで実施してきたペプチドのフラッシュ精製が、標準的な TFA 濃度で本当に十分に作用しているのか、疑問を持ち始めました。
ここで、計算してみようと思います。37 アミノ酸で構成される GLP-1 ペプチドは 13 のイオン化可能な側鎖を持ち、サンプル量 50mg はモル数に変換すると 11.9μmoles のペプチドに相当し、最大で 13 倍のプロトン(154.7μmoles)が消費されることになります。 TFA 濃度が 0.1%の場合、約13mM に相当し、非常にプロトンが多いように感じられます。 しかし、これまで実施した平均的なフラッシュ精製(移動相 300 mL 程度)の過程で、カラム全体を流れる TFA(プロトン)は 3.9mmoles にすぎません。これは、クロマトグラフィーに影響を与えるために投入されるサンプルの 3倍近いプロトン数になります。この比率が 1:1 またはそれ以上に近い条件ではどうなるでしょうか?
まず、Biotage® Isolera™ Dalton 2000 でフォーカスグラジエントをせっておし、移動相へ添加剤として TFA の濃度を変えながら約 40mg の粗 GLP-1 の精製を実施しました。まず、通常とは逆に、TFA 濃度を 0.05%へ減らした移動相を用いて GLP-1 を精製してみました(図 2)。
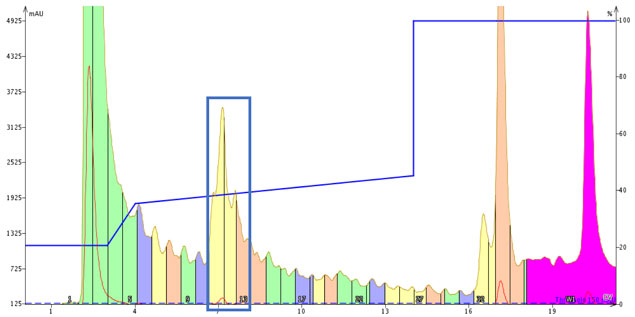
図 2: 0.05% TFA を添加した移動相を使用して最適化されたフォーカスグラジエントを用いた GLP-1 の精製。 フラクション 11-13(青枠)は、さらに分析用 HPLC で個別に分析しました。
得られた主要ピークは鋭くなり、精製がうまく進んでいることを示唆していますが、分析 HPLC では得られた結果を示します(図 3)。
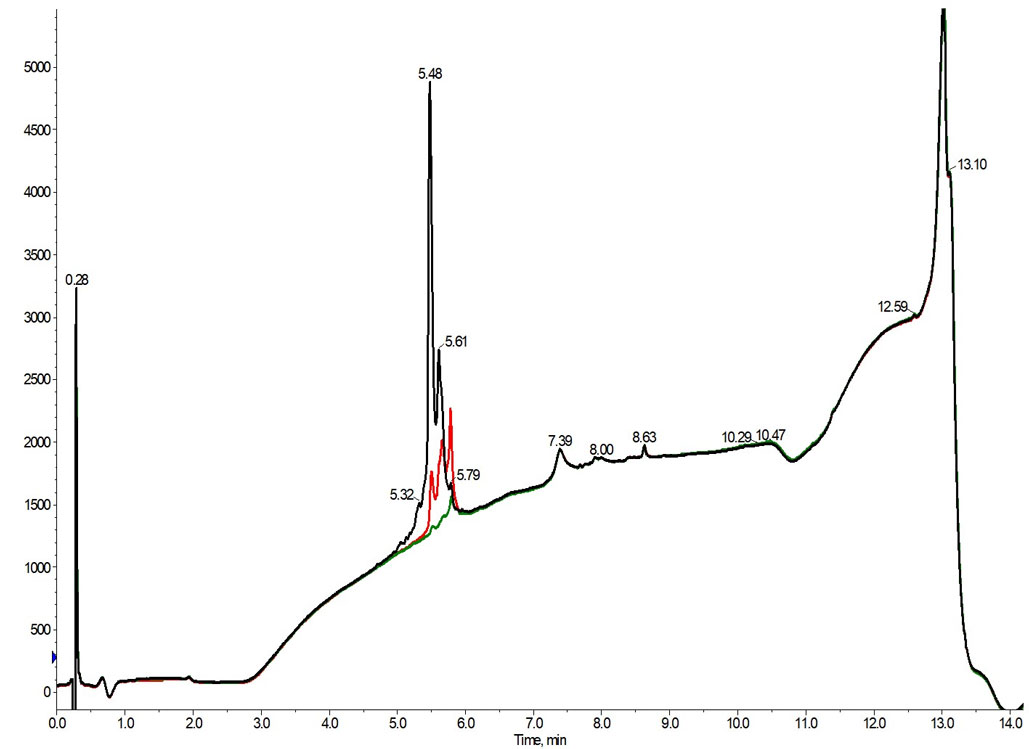
図 3: フラクション 11(黒)、フラクション 12(赤)、フラクション 13(緑)の純度を分析した分析クロマトグラムを重ね合わせた結果。
残念ながら、これら 3 つのフラクションはいずれも不純物を含んでおり、HPLC で研磨することなくアッセイに移行するのに十分な純度を有していませんでした。しかし、精製条件を考えれば、これは驚くような結果ではありません。これらのピークはクロマトグラムの非常に早い段階で溶出します。これは、目的のペプチドおよび関連不純物の酸性または塩基性アミノ酸側鎖(より親水性が高く、したがって保持が弱い)のイオン化が不完全であることを示唆しており、ひいては移動相に残存するトリフルオロ酢酸対イオンによるイオンペア効果が最小化となっている可能性があります。
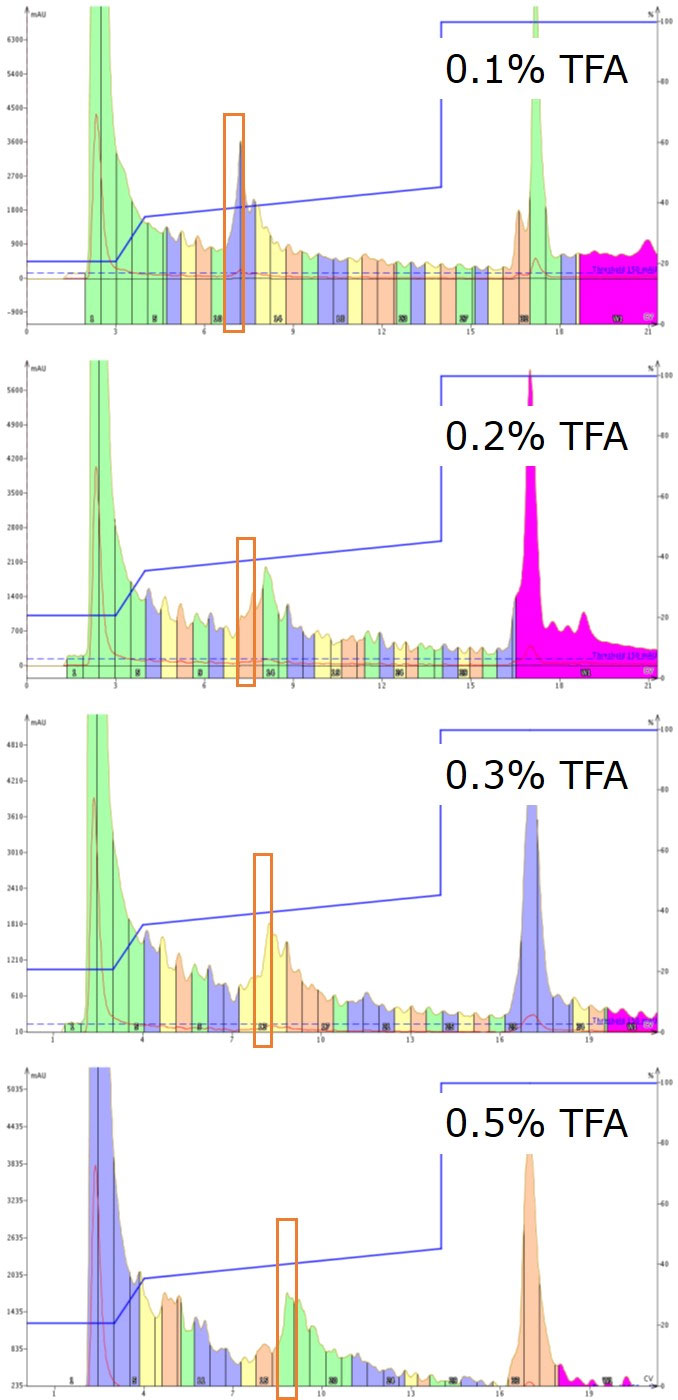
図 4: 移動相の添加剤として TFA 濃度を増やしながら、フォーカスグラジェントを用いた GLP-1 の精製。 すべてのフラクションは、分析用 HPLC 純度解析のために別々に保管されました。最高純度のサンプルは、オレンジ色のボックスで示しています。
図 4 は、移動相の TFA 濃度の増加だけで起こるクロマトグラフィーの変化を示しており、非常に興味深いものになっています。低濃度では、非常にシャープなピークが観察され、TFA の濃度を上げるにつれてピークはブロードになります。今回評価した TFA の濃度が中間の場合、ピークの幅が最も広くなり、フォローアップ分析に最も苦労しました。しかし、私にとって最も興味深いのは、評価した TFA の最高濃度で、ピークのシャープさが戻ってきたことです。移動相に 0.5%の TFA を使用した場合、精製の過程で合計 19.6 mmol がシステム内に流れます(移動相 300 mL 程度)。これは、ロードした粗ペプチドの考えられるすべてのイオン性側鎖に対して 127 倍の過剰量に相当します。 重要なのは、TFA の添加量を増やすことで化合物の保持力が高まり、目的化合物と隣接する不純物をより明確に分離できるようになることです。
ピークが明瞭であれば、その後の分析を簡略化でき、労力を減らすことができますが、ペプチド精製における真の成功の尺度は、純度と回収率です。各精製で複数のフラクションを分析した後、私は上記の添加剤の増加による各精製の試みから最も純粋なフラクション(オレンジ色のボックス)のみの分析クロマトグラフィーを強調することにしました(図 5)。
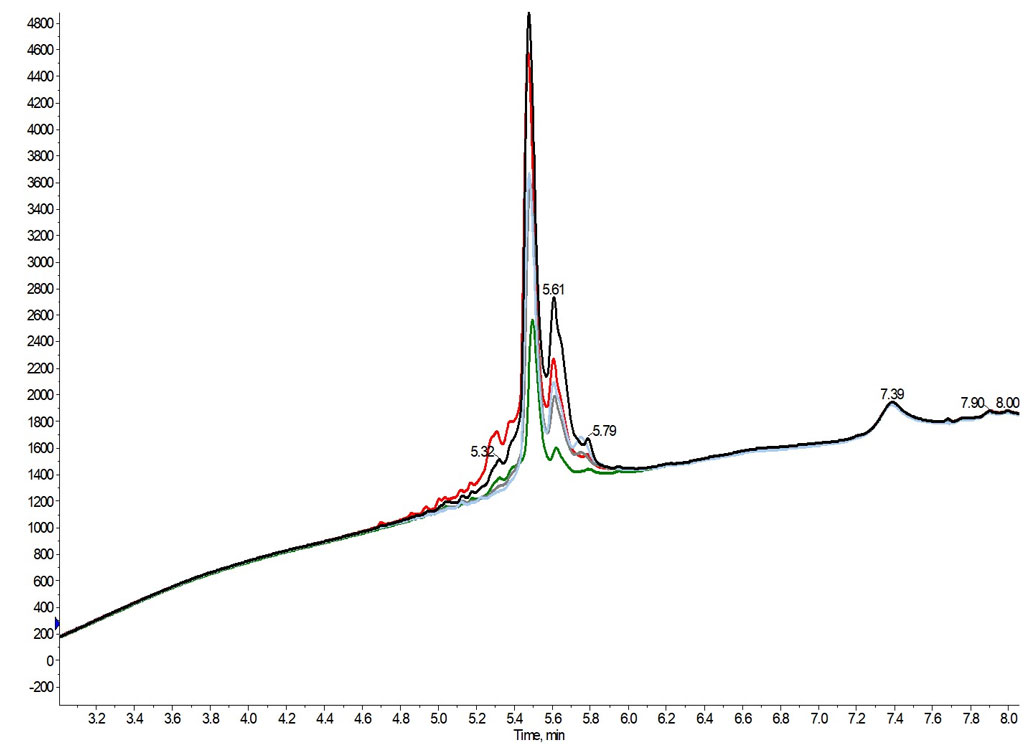
図 5: 0.05% TFA(黒、純度 64%) 0.1% TFA(赤、純度 68%) 0.2% TFA(緑、純度 85%)0.3% TFA(灰、純度 67%) または 0.5% TFA(水色、純度 63%)を移動相添加剤として使用して精製した GLP-1 の最も純粋な分析 HPLC クロマトグラム(わかりやすく拡大したもの)です。
これらのサンプルは、分析による純度を確定する前に、それぞれ同じように濃縮、溶解、希釈し、相対的な回収率に関する情報も得ることができました。興味深いことに、私の考えでは最も成功しなかった精製条件(0.05% TFA)では、他の添加剤濃度と比較して、1 つのフラクションで最も高いペプチド回収率が得られました。 分析した各フラクションの純度は比較的安定していますが、移動相に低濃度の TFA を使用して回収したフラクションには、フラクション前後に溶出する不純物が含まれており、今後の精製条件を複雑化することが示唆されました。
これらのデータを考えると、少し断裂しています。低 TFA 濃度で達成された回復は、フォローアップ HPLC 研磨を考慮する場合、明らかに魅力的です。しかしながら、最高濃度の TFA に対して達成されるクロマトグラムの明瞭さは、個々のフラクション分析を単純化します。より多くの画分を組み合わせるだけで、回収率を向上させることができます。I は、修飾剤濃度が変化するにつれて、より有意な純度の差を予想していました。しかし、これは未来にもっと多くをもたらすとても興味深い実験で
した !
これまで実施したデータを見ると、精製についてちょっと悩みます。 低濃度の TFA で達成された回収率は、HPLC 精製のフォローアップを考慮すると、間違いなく魅力的です。しかし、そうは言っても、最高濃度の TFA で達成されるクロマトグラムの透明性は、個々のフラクション分析を単純化します。 より多くのフラクションを組み合わせるだけで回収率を向上させることができるのです。添加剤の濃度が変わると、純度にもっと大きな差が出ることを予想していました。しかし、純度以外にも利
点となるデータが得られたことは非常に興味深い実験であり、今後につながるものです。
日本語化:2021年12月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(570KB,2021/12)