April 17, 2020
Elizabeth Denton
ペプチドは、本質的には、側鎖に電荷がある官能基をもつアミノ酸で構成されています。これらの官能基部分の電荷の状態は、ペプチド精製におけるHPLC カラムのメディアによる保持とピーク形状の両方の観点から、クロマトグラフィーの挙動に大きな影響を及ぼします。しかしながら、逆相クロマトグラフィーによるペプチド精製は、ほとんどの場合、移動相溶媒に酸性添加剤を加えておき、pH2~3 を維持して精製を行います。私たちは移動相に別の試薬を添加して精製結果の改善を試みたことがあるでしょうか?
今回の投稿では、オキシトシン(CYIQNCPLG‐NH2)の精製における移動相pHの影響について検討します。オキシトシンは、生物活性をもつ 9アミノ酸のペプチドであり、分子内にジスルフィド結合を1個もつ環状ペプチドになります。
オキシトシンの場合、合成や発現後において、何らかの生物学的評価を実施する可能性が高いため、環状化ペプチドと直鎖ペプチドを分離することが重要です。私が合成したすべてのペプチドと同様に、ギ酸を添加した移動相溶媒での分析HPLC/MSにより粗ペプチドを分析しました。0.1% ギ酸の添加の条件下で pH は 2.5~2.7 になります。HPLC 分析結果、直鎖および環状化ペプチドの2種類が十分に分離され、明確に確認できて安堵しました(図1)。
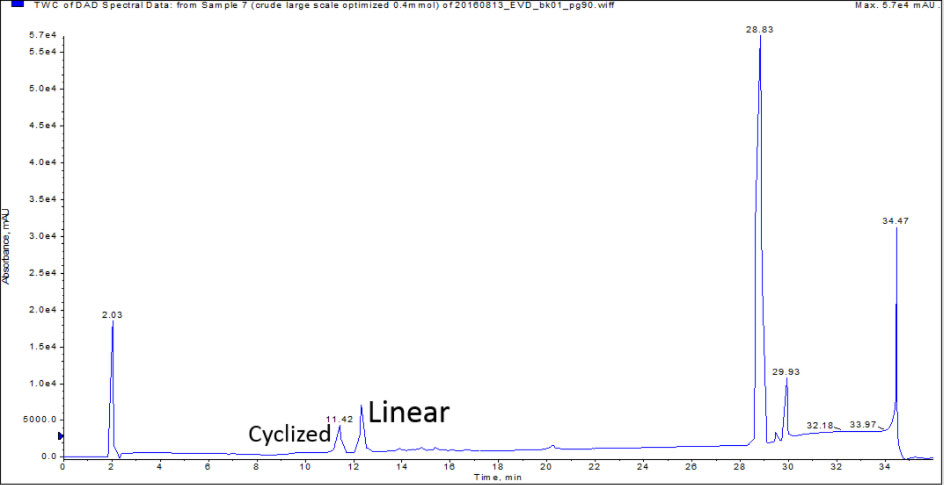
図 1: 直鎖およびジスルフィド結合をもつ環状オキシトシンの両方を含む分析HPLC。
残念ながら、Biotage® SNAP Ultra C18*カートリッジを使用してフラッシュクロマトグラフィーで直鎖および環状化のこれら2つのペプチドを分離することを検討しました。様々なグラジエント条件で実施しましたが、残念ながら、環状化オキシトシンと直鎖オキシトシンを分離することができませんでした。この移動相条件では精製が難しいと結論付けざるをえませんでした(図2)。
*現在、Biotage SNAP Bio C18 は Biotage® Sfär Bio C18 Duo 300 Å 20 μm へ切り替わっております。同じメディアを使用しております。リンク:https://www.biotage.co.jp/products_top/peptide-synthesis-purification/sfar_bio/
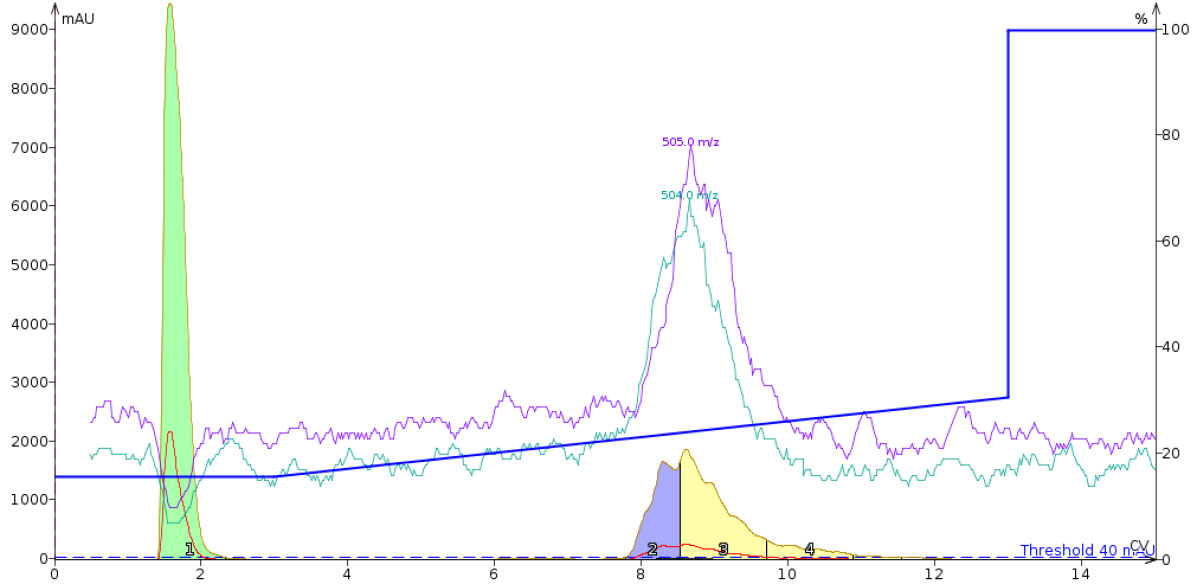
図 2: DMSOに溶解した環状化オキシトシンと直鎖オキシトシン分離を検討したフラッシュカラムクロマトグラム。このグラジエントでは、0.1%TFA を含む移動相溶媒でアセトニトリル濃度を 15%から 30%まで変化させました。
フラッシュクロマトグラフィーをあきらめ、HPLCに戻すのではなく(私はフラクションコレクターを持たない分析 HPLC しか持っていません)、オキシトシンのアミノ酸配列や、直鎖ペプチドと環状化ペプチドをクロマトグラフィーで分離できる特徴について考えました。直鎖オルニチンのアミノ酸配列から2つのシステイン残基のチオール基に注目しました。このチオール基(pKa約8.37)は pH9 以上の塩基性条件下で電荷をもつことができるため、LC/MS で使用できる塩基性の移動相添加剤を探索したところ、0.1%水酸化アンモニウム(pH~10.7)が使用できることがわかりました。フラッシュクロマトグラフィーを確実の実施するため、システインのチオール基のすべてが完全な脱プロトン化させるためにpHはチオール基の pKa より1~2上になるように調整しました。
オキシトシンを塩基性移動相でフラッシュクロマトグラフィーによる精製を実施すると、劇的に結果が変わったことにショックを受けました。なお、このペプチド精製ではLC/MSのネガティブモードにて分析を行いました(図3)。
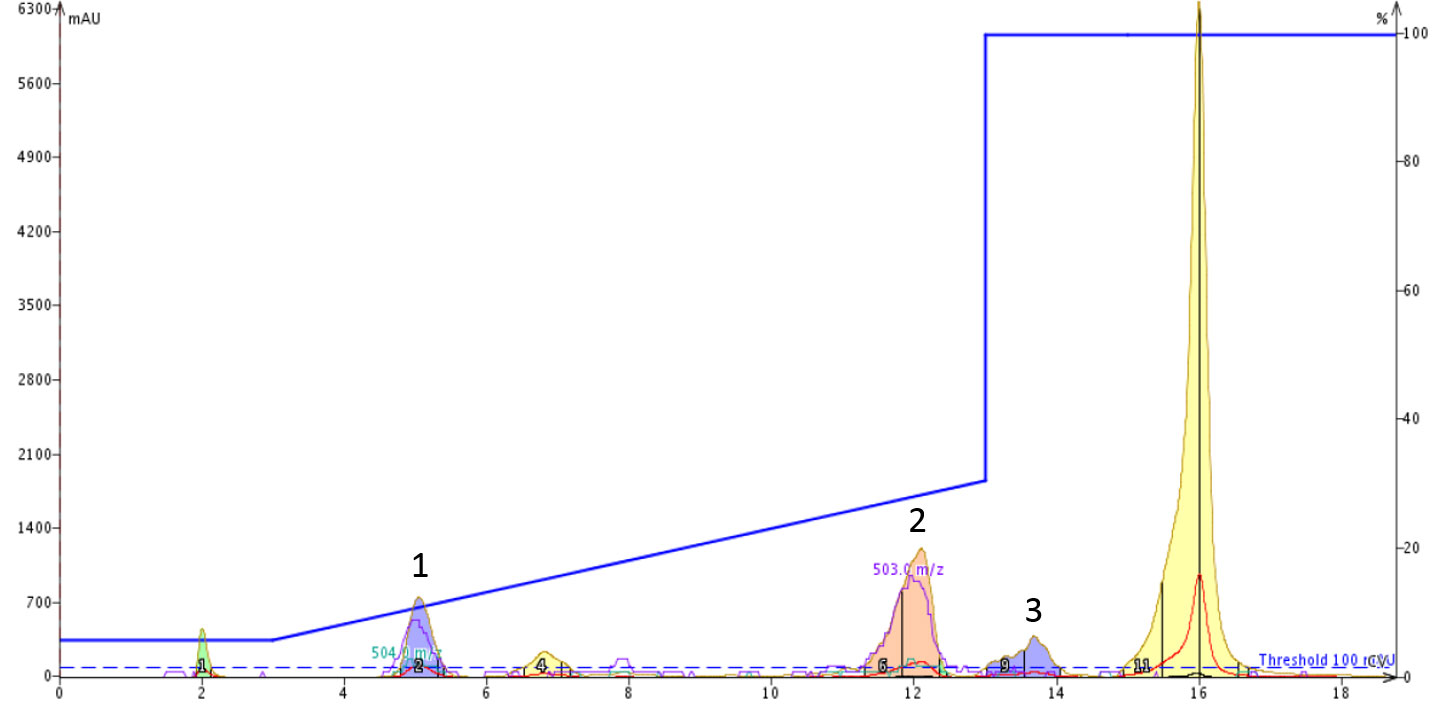
図 3: DMSO に溶解した環状化オキシトシンと直鎖オキシトシン分離を検討したフラッシュカラムクロマトグラム。このグラジエントでは、0.1%水酸化アンモニウムを含む移動相溶媒でアセトニトリルの濃度を 5%から30%まで変化させました。
HPLC/MS により3つの主要ピークを分析すると、環状化ペプチドがピーク1内にほとんど含まれており、線状ペプチドはピーク2と3の両方に含まれることがわかりました(私は最後の大きなピークにはペプチドが含まれていないことを確認しました) 。通常の精製においては、直鎖オキシトシンは側鎖の脱プロトン化されたため早い時間にカラムから溶出されると予想しましたが、ここでは予想した結果にはなりませんでした。線状ペプチドが極端に保持されたことを考えると、移動相に存在するアンモニウムイオンはイオン対として作用しており、マイナスの電荷を効果的に遮蔽し、ペプチドの保持力を増加させていると考えられます。
DMSO がペプチド溶液の移動相およびpH添加剤への近接に影響していないことを確認するために、私は環状化と直鎖ペプチド混合物を 0.1% 水酸化アンモニウムを含む 5% の.アセトニトリル水溶液に溶解しました。SNAP Ultra C18 カートリッジに注入する前に、ペプチドが完全に脱プロトン化を確認しました(図4)。
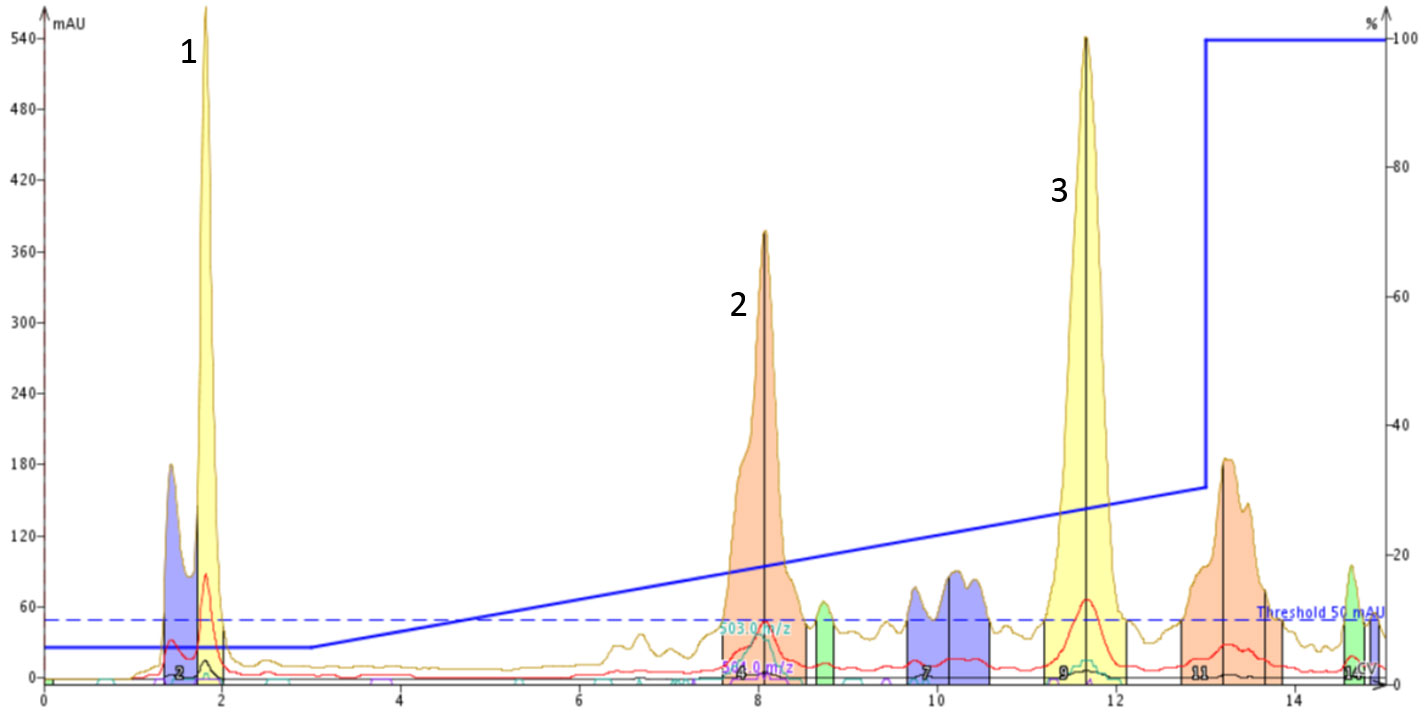
図 4: 0.1% 水酸化アンモニウムを含む5%アセトニトリル水溶液に溶解した環状と直鎖のオキシトシンの分離を検討したフラッシュカラムクロマトグラム。このグラジエントは、0.1% 水酸化アンモニウムを含む移動相溶媒でアセトニトリル濃度を 5% から 30% まで変化させました。
ペプチド混合物をグラジエントの初期の移動相条件で溶解すると、一般的に船体的なピークの分離パターンは維持されます。今回の結果においてはSNAP Ultra C18 カートリッジに注入する前に、20mg の粗ペプチドがグラジエント初期条件の溶液 4mL に完全に溶解していなかったことに言及する必要があります。これが、今回の結果の原因である可能性が高いです。興味深いことは、環状化されたペプチドが DMSO の非存在下ではカラムによるが保持がほとんどありませんでした。一方、直鎖ペプチドは前の結果と同様に明確に2つのピークで検出されました。ペプチド混合物は塩基性移動相に溶解するので、2つのピークのうちの一つはチロシンのヒドロキシル基(pKa~10.46)の部分的脱プロトン化から生じると推測しました。このような小さなペプチドにマイナスの電荷が加わっただけで最大電荷が変化し、C18 カラムによる保持力に大きな影響を与えることがこの結果から推測することができます。
フラッシュカラムクロマトグラフィーの分解能は HPLC よりも劣りますが、移動相のpHを調節することによって、その祖サンプルからペプチドを精製できることを実証できました。私は、将来、HPLC を使用せずとも、より長いペプチドに対してこの技術(フラッシュクロマトグラフィー)を検討していることを確信しています!
移動相にpH添加剤を加えて、pH変化によるペプチドの精製を試したことがありますか?
フラッシュクロマトグラフィーは精製時間と労力を大幅に短縮することができます。フラッシュクロマトグラフィーについて関心がありますか? 下記のホワイトペーパーで、フラッシュクロマトグラフィーについて学ぶことができます。
日本語化:2021年12月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(540KB, 2021年12月)