September 26, 2017
Elizabeth Denton
逆相 HPLC では現在、メディア、粒子径、さらには粒子孔径が異なる様々なカラムが存在しており、多くの選択肢が提供されています。ペプチド精製においてしばしば認められている懸念は、逆相精製を実施した際のペプチド回収率であり、特に貴重なペプチドについては回収率について敏感になります。私は逆相フラッシュクロマトグラフィーによるペプチド精製を用いたとき、ペプチドの回収率にはどのように影響を受けるか考えました。
今日の投稿では、逆相フラッシュクロマトグラフィーを用いて、純度と長さが異なる 2 種類のペプチドの回収レベルを比較しました。2 種類のペプチドを比較するだけでなく、移動相の pH を変えることによって回収率が影響されるかについても評価しました。
逆相フラッシュクロマトグラフィーでペプチド精製を始めたとき、私が最初に浮かんだ懸念の 1 つは、この精製方法でどの程度のペプチドが失われるかということでした。特にチャージ量が少ない場合、ペプチドの回収量が減ることについては常に懸念があります。Biotage® SNAP Bio C18* カートリッジを用いて、添加剤を加えた移動相に性質の異なる 2 種類のペプチドの回収量を検討することにしました。使用するカラムには、ペプチド精製に最適な C18 の小さな粒子サイズ 20μm と大きな 細孔サイズ 300Å の完全にキャップされた球状のシリカビーズからなるメディアが含まれています。
私は比較的短くて合成純度が高いペプチドを利用して、回収率の評価を行いました。私は、私のカップリング試薬として DIC/Oxyma を用いて、Biotage® Initiator+Alstra で 10 残基のペプチドである ACP65-74 を合成しました。合成は予想通り成功しましたが、HPLC の UV スペクトルによる分析すると、後半に保護基の残渣が溶出されたため、総合的な純度は低下して 36% となりました(図1)。
*現在、Biotage SNAP Bio C18 は Biotage® Sfär Bio C18 Duo 300 Å 20 μm へ切り替わっております。同じメディアを使用しております。リンク:
https://www.biotage.co.jp/products_top/peptide-synthesis-purification/sfar_bio/
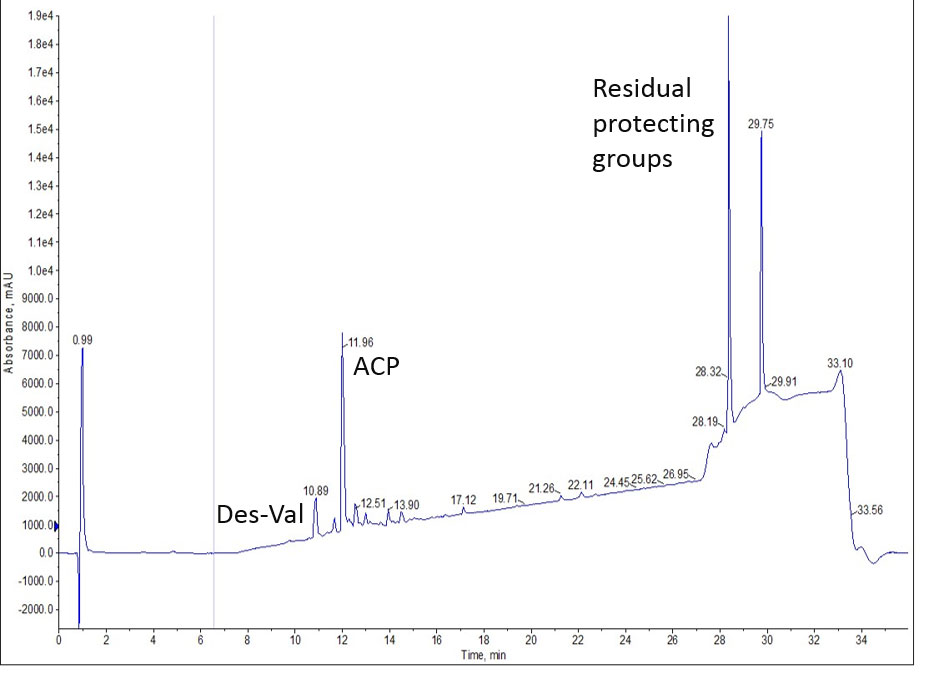
図 1: ACP ペプチドの分析用 HPLC クロマトグラム。ペプチドの純度は 36%になります。
精製方法について説明します。粗ペプチド約 50mg を DMSO に溶解し、10g SNAP Bio カートリッジにチャージし、Biotage® Isolera Dalton で精製を行いました(図 2)。ペプチドはアセトニトリルの濃度が 30% 付近で溶出することを示唆する分析クロマトグラフィーに基づいて、10~50% のアセトニトリルの 10 カラムボリュームのグラジエントで実施しました。
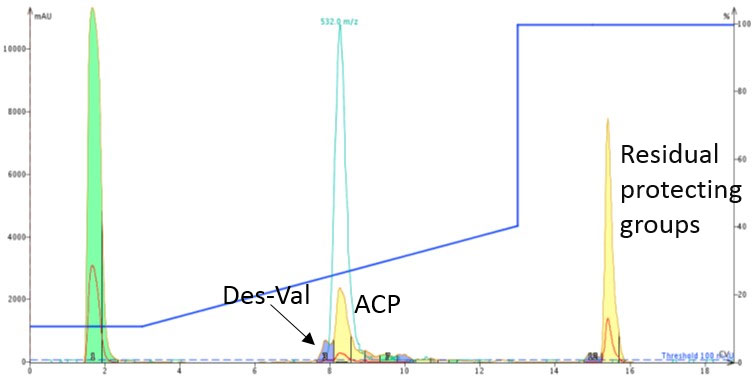
図 2: DMSO に溶解した ACP 48.1mg を 10g の SNAP Bio C18 カートリッジにチャージして精製した際のクロマトグラム。8 カラムボリューム付近のピークを回収して回収率を計算しました。
フラッシュ精製のカラムは HPLC カラムと比較すると大きな粒子径になりますが、Val が欠損した配列と目的物を分離することに成功しました。目的物が含まれるピークを回収し、濃縮して乾燥すると、ペプチドの最終純度は 92%で得られ、予想される回収量 17.3mg のうち 14.5mg を回収できました。この結果は 96% の回収率に相当します!
次に、GLP-1 ペプチドを精製しました。GLP-1 は 37 アミノ酸からなるペプチドで、およそ 26% の純度で合成できました(図 3)。この精製では、水酸化アンモニウムを添加した移動相を用いて塩基性 pH に変更して実施することにしました。私は過去にこの戦略を用いて、精製結果が大きく改善した実績がありました。しかし、私は今回以前では回収効率について評価していませんでした。
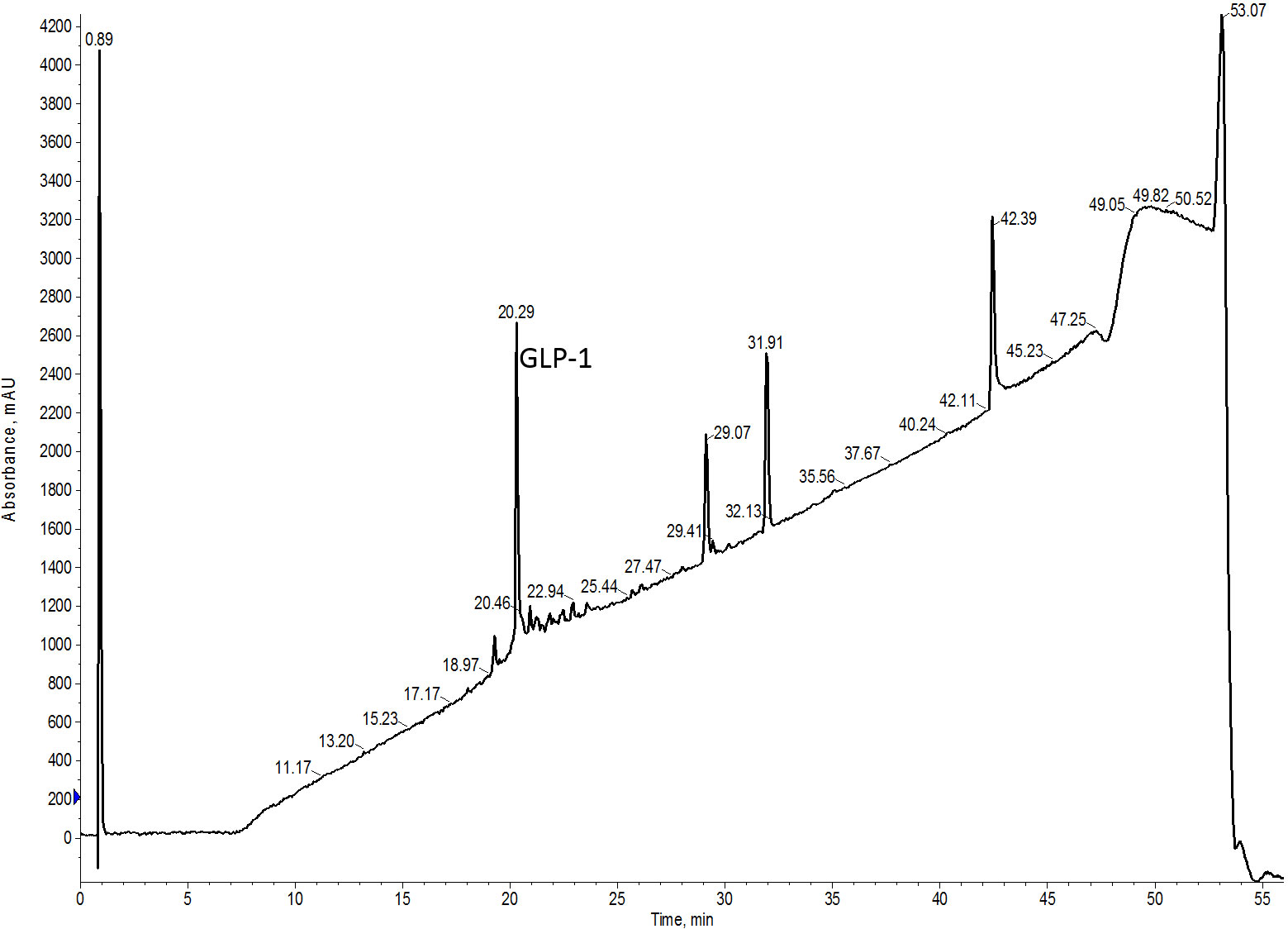
図 3: GLP-1 の分析用 HPLC クロマトグラム。ペプチドの純度は 26% になります。
私は GLP-1150mg を DMSO 約 1mL に溶解し、25g SNAP Bio カートリッジにチャージし、Biotage® Isolera Daltonで精製を行いました。カートリッジサイズで 25 g を使用したのは、精製する粗ペプチドの量から変更したわけではなく、副生成物を含んだペプチド溶液をチャージするにあたり DMSO 量 が増加したためです。
私はアセトニトリル濃度を 20~70%のグラジエントで精製を行いました(図 4)。私分析クロマトグラフィーでは、目的のペプチドはアセトニトリルの濃度が約 40% で溶出することが示唆されていますが、これは酸で pH 調整した移動相を用いた時のデータになります。結果として、私はこのグラジエントで塩基性 pH 条件におけるフラッシュクロマトグラフィーを用いて精製を実施しました。私は塩基性条件においても同じ濃度付近で溶出されることを期待しました。
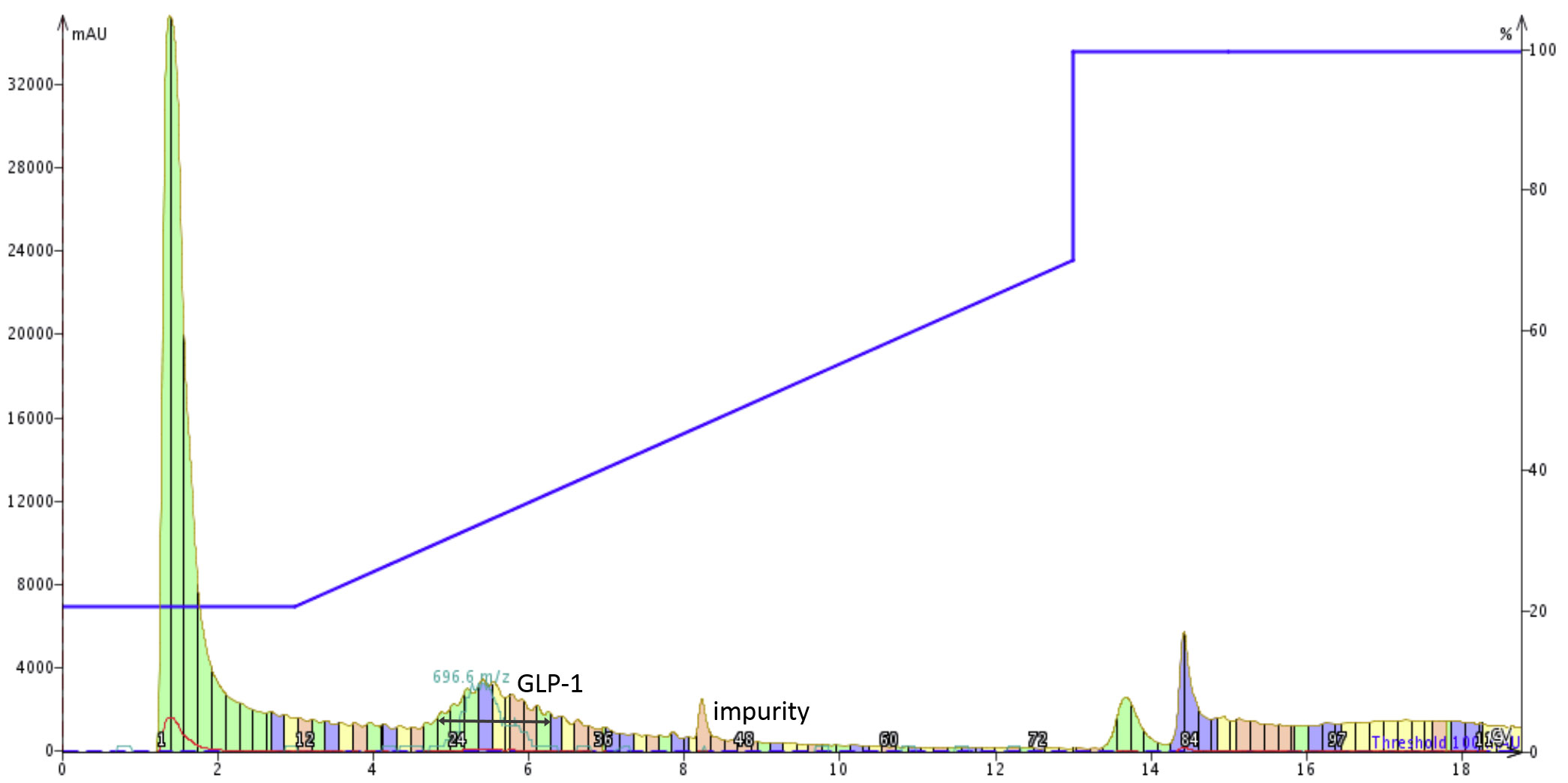
図 4: DMSO に溶解した ACP 147.5 mg を 25 g の SNAP Bio C18 カートリッジにチャージして精製した際のクロマトグラム。5~6カラムボリューム付近のピークを回収して回収率を計算しました。
目的のペプチドは、塩基性の移動相によるグラジエントではほぼ 2 カラムボリュームで溶出しました。しかし、酸性条件下での精製では目的のペプチドが溶出する付近別のピークが観察されました(データは示していません)。保持時間が変わったことは、不純物を除外してペプチド純度の増加につながりました。MS スペクトルのピーク(淡緑色の線)を目安として、目的ペプチドを含むピークを回収しました。この溶液を濃縮して乾燥すると、期待されるサンプル量 39.8mg のうち 33.7mg を回収し、最終純度は 87%になりました。これは回収率は 85%に相当しました!
この純度レベルでは、ほとんどの生物学的アッセイでの使用に耐えるほど十分ではありませんが、合成時の混合状態から、目的のペプチドを精製することができました。アッセイにも使用できる純度までには最終的に HPLC を実施することになりますが、HPLC 精製時のチャージ量を大幅に減らすことができました。
これまでの結果をまとめると、今回のデータは、中程度の純度の粗ペプチド (単純精製)から、または様々な条件下での最終的な HPLC 精製前に、逆相フラッシュクロマトグラフィーを実施してもペプチドをほとんど失うことなく、高い回収率で得られることを示唆しています。さらに重要なことは、移動相の添加剤の変化にもかかわらず高い回収率が維持されたことです。
精製中のペプチドが失われないためにはどのような方法がありますか?
フラッシュクロマトグラフィーを用いてペプチドの最終的な純度を改善できる戦略についてさらに詳しく知るには、リンク を参考してください。高純度ペプチドを得る方法についてさらに学びましょう。
日本語化:2020年9月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(2020年9月, 390KB)