April 12, 2020
Elizabeth Denton
私が合成したほとんどすべてのペプチドは、その後逆相 C18 カラムを用いて精製できました。C18 はほとんど良い結果が得られましたが、ときどきうまくいかない場合もありました。私の C18 の精製で失敗したとき、HPLC 実施する前に、私が精製の結果について予測できたかどうか考えてみました。それ以来、私はペプチドのアミノ酸配列がペプチド精製時のクロマトグラフィーに影響を与えている可能性について考えを進めることにしました。
逆相クロマトグラフィーには多くの固定相に様々な官能基が存在しますが、本日の投稿では、ペプチド精製において C18または C4のメディアを用いてペプチドを精製したときに観察された違いについて述べていきます。
40 アミノ酸以上の大きな配列あるいは非常に疎水性の高いペプチドを精製する場合には、典型的には C4 のカラムが選択肢になります。しかし、非常に疎水性が高い場合にどうでしょうか。また、C4 が天然に存在する両親媒性のペプチドの精製にも有用かどうか検証しました。
配列、アミノ酸組成、疎水性の平均(Gravy)が異なる3種類のペプチドで精製を検討することにしました。Gravy はアミノ酸組成を用いて計算されるパラメーターであり、ペプチドの全体的な疎水性の特性を表します。Gravy の値は基本的には -2(親水性)から +2(疎水性)の範囲に
まず、ChemMatrix®レジンを用いて37アミノ酸ペプチドである GLP-1を合成し、合成したペプチドを用いて検討を開始しました。このペプチドは Gravy で調べたペプチドの中で最も長いものなりますが、値は 0.614と最も親水性も高くなりました。このペプチドの両親媒性の性質はよく知られており、Gravy 値がゼロに近い値を示したことで、この値の妥当性について再認識することができました。分析 HPLC によりペプチドが溶出するアセトニトリル濃度とグラジエントの最適化の戦略 を用いてこのペプチドの精製を行いました。私は最初に、20%から70%のアセトニトリルのグラジエントで Biotage® SNAP Bio C18カートリッジ*1 を用いて精製を行いました(図1)。
*1 : 現在、Biotage SNAP Bio C18はBiotage® Sfär Bio C18 Duo 300 Å 20 μm へ切り替わっております。同じメディアを使用しております。リンク:https://www.biotage.co.jp/products_top/peptide-synthesis-purification/sfar_bio/
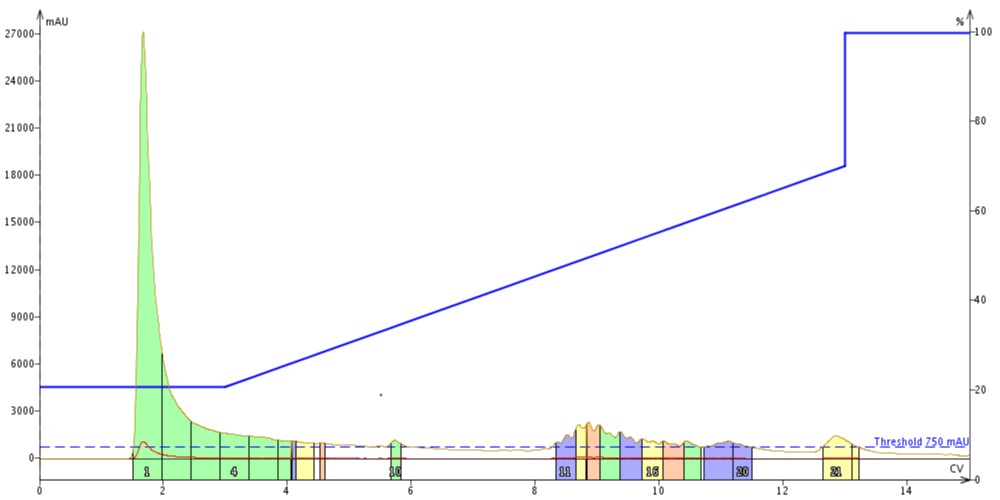
図 1: GLP-1 を 300Å の C18 カラムを用いて精製しました。ペプチドは約 9カラムボリュームで溶出しました。
それから、まったく同じ勾配を使って、Biotage®SNAP Bio C4カートリッジ*2で同量のペプチドサンプルを注入して精製を実施しました(図2)。
*2 : 現在、Biotage SNAP Bio C4 はBiotage® Sfär Bio C4 Duo 300 Å 20 μm へ切り替わっております。同じメディアを使用しております。リンク:https://www.biotage.co.jp/products_top/peptide-synthesis-purification/sfar_bio/
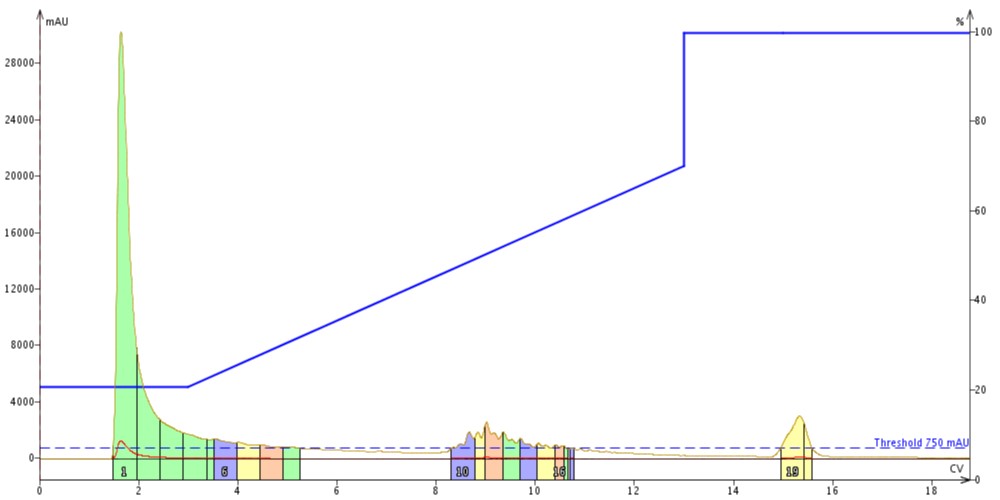
図 2: GLP-1 を 300Å の C4 カラムを用いて精製しました。ペプチドは約 8.5 カラムボリュームで溶出しました。
このペプチドは合成装置による合成後において特に純粋が高いわけではありませんが(この合成のプロトコルは最適化されていないため予想外ではありません)、両方のクロマトグラムで目的のペプチドが含まれる主要なピークは同定可能です。C4 のカートリッジで精製すると、ペプチドはアセトニトリルの濃度がやや低く地点で溶出します。しかし興味深いことに、その差異は 1カラムボリューム未満です。やや親水性にもかかわらず、ペプチドの長さが精製に影響を及ぼし、ペプチド溶出に必要なアセトニトリル濃度の差を小さく保つようです。
次に 18A として知られる 18アミノ酸ペプチドの精製を試みました。このペプチドは、本研究で評価した 3つのペプチドで最も両親媒性であり、Gravy 値は -0.478 です。以前に行ったように、サンプルの一部をまず Biotage® SNAP Bio C18 カートリッジに注入し、20%~70%アセトニトリル、リニアグラジエントで溶出しました(図3)。
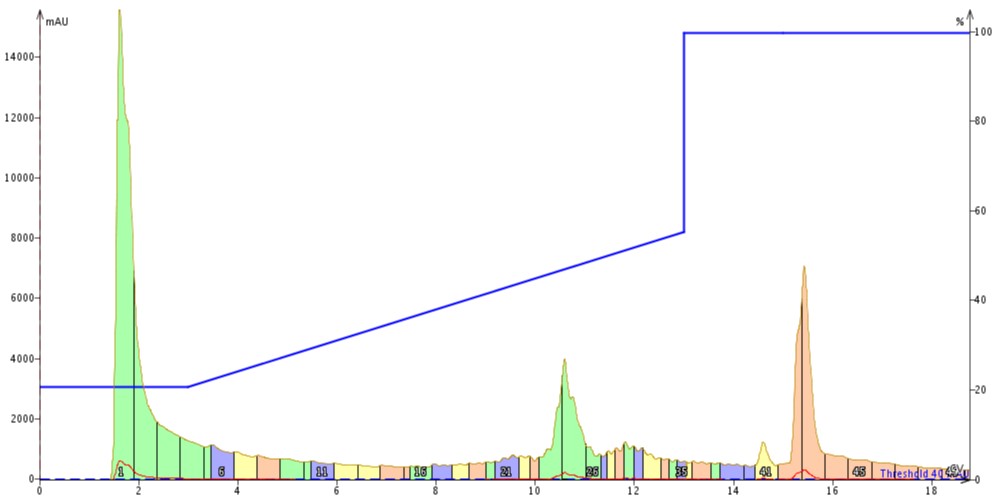
図 3: C18 カラムを用いて精製した 18A。ペプチドは約 11カラムボリュームで溶出しました。
そこで、同じグラジエントを使って、私は同量の合成した 18A を私の Biotage® SNAP Bio C4 カートリッジに注入して精製しました(図4)。
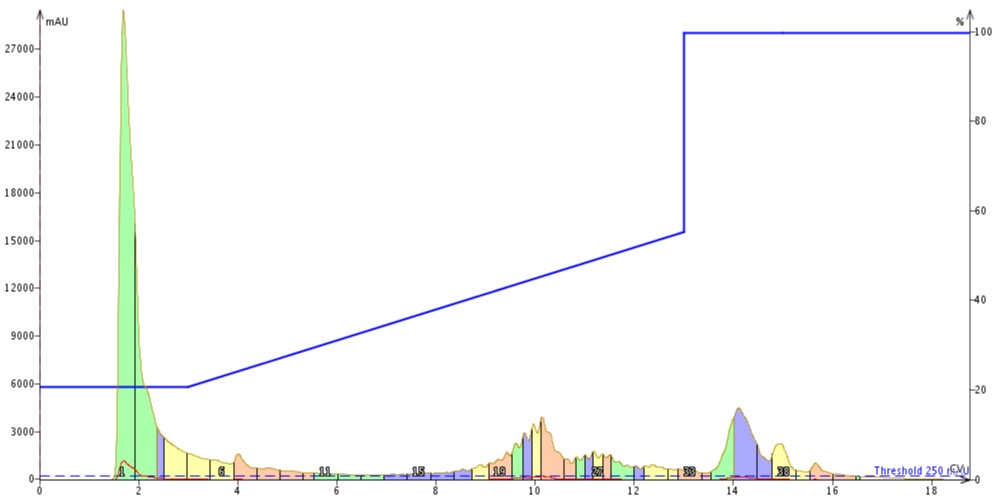
図 4: C4 カラムを用いて精製した 18A。ペプチドは約 10カラムボリュームで溶出しました。
GLP-1 で見られるように、C4 メディアを用いて精製した場合、C18 メディアよりも約1カラムボリューム分早くペプチドが溶出しました。しかし、ピークの形状は明らかに異なりました。C18 メディアを用いて精製した場合、ペプチド生成物ピークはシャープになり、C4 メディアで精製した場合は広いピークになりましたが、多くの不純物を分離することができました。
最後に、65~74 番目のアミノ酸配列からなる Acyl Carrier Protein のフラグメントを精製しました。このペプチドは比較的短いペプチドで、Gravy 値が 0.460 であるにもかかわらず、合成が困難であると考えられ、最も研究・合成されている疎水性のペプチドとなっています。精製としては、10%MeCN から開始し、50%MeCN で終わるグラジエントでそれぞれ Biotage® SNAP Bio C18 カートリッジと Biotage® SNAP Bio C4 カートリッジの両方で精製を実施しました(図5、6)。
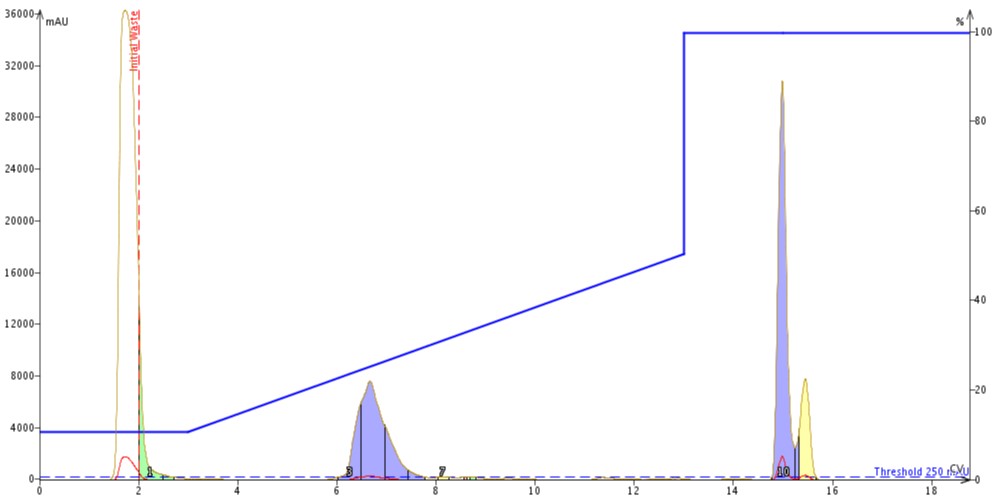
図 5: C18 カラムを用いて精製した ACP。ペプチドは約 8カラムボリュームで溶出しました。
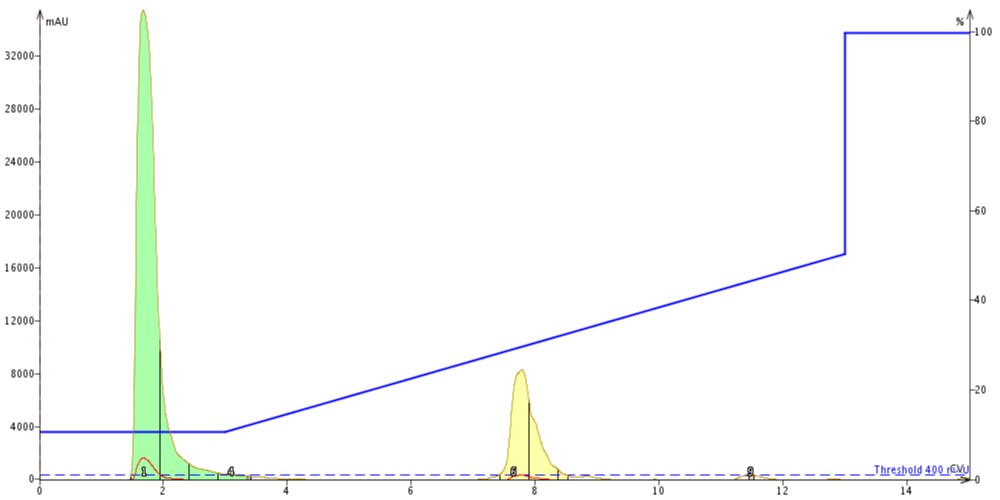
図 6: C4 カラムを用いて精製した ACP。ペプチドは約 7カラムボリュームで溶出しました。
このペプチドの精製では、合成装置後の状態でも比較的純度が高く、精製自体は比較的簡単でした。興味深いことに、目的ペプチドの溶出の違いは約 1カラムボリュームでした。疎水性をもつ短いペプチドにおいても C4 メディアによるペプチド保持の減少に影響している可能性が出てきました。18A ペプチドと同様に、C4 を用いて精製した ACP のピークも広がっていました。
このペプチド精製における評価では、配列の長さだけでなく疎水性も異なる 3つのペプチドを、C4 または C18 カラムのいずれかを用いて精製しました。予想通り、3つのペプチドはすべて、C18 カラムよりも C4 カラムの方が保持されにくいことがわかりました。しかし、予想外のこととして、2種類の短いペプチドで観察されたワイドなピークでした。この結果については、逆相精製における一般論によって説明することができます。短いアルキル鎖は相互作用する面が少なく、全体的な疎水性相互作用の強度が弱くなります。これがグラジエントの影響に及ぼし、ペプチド溶出中のピークに広がりをもたらしたと考えられます?
本日の投稿で評価されたペプチド精製については、溶出のカラムボリュームやピークの違いは小さかったです。しかし、よく使用されているC18ではなくC4 を選択することで、精製結果が変わる可能性が示されました。ここで観察された違いは、将来の精製におけるグラジエント選択の指針として使用していきます。
逆相ペプチド精製で他に使用できるメディアはありますか?
ペプチド精製がフラッシュクロマトグラフィーを使用することで精製における時間と労力を削減できるかについて リンク も参考にしてください。
日本語化:2020年9月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(2020年9月, 380KB)