August 25, 2019
Elizabeth Denton
逆相フラッシュクロマトグラフィーは、精製時間と労力を減らせることが認識されたため、ペプチドケミストによって徐々に利用されるようになってきました。フラッシュカラムに使用されるよりメディアは、カラムボリュームに対して大きなサンプル量をチャージできます。そして、従来のHPLC法と比較した場合よりも分解能が低いにもかかわらず、ペプチドを高純度で精製できる可能性があります。時にはフラッシュ精製において純度が十分でない状況もあります。その時、いったい何ができるでしょうか?
今回の投稿では、伝統的なリニアグラジエントよりも高い純度のペプチド精製を達成するために、フォーカスグラジエントについて紹介していきます。
ペプチドは天然においても20種類のアミノ酸が連なって構成されており、現在においてはその特性は予測不可能です。合成したペプチドが直線的な構造なのか、それともレジンから切り出し後においても全く溶けない配列であるか、これらのペプチドは通常のグラジエントではまったく精製できないことが多いです。
私の経験では、ほとんどの実験グループが、アセトニトリル1分間あたり1%あるいは2%の変化、それ以外の変化量を用いた標準的なグラジエントでペプチドの精製を始めていきます。このベースラインが確立されると、グラジエントを構築して目的のペプチドの精製を実施することになります。ペプチド精製で逆相フラッシュクロマトグラフィーを用いる場合においても、同様のプロトコルを採用しています。では、どのようにグラジエントを構築してペプチドの純度を上げていくのでしょうか。
逆相フラッシュクロマトグラフィー では、グラジエントの傾きを小さくし、精製時間を延ばしてもうまく機能しないことは確かです。これはHPLCでもよく観察されるように、ピーク間の分解能を増加させるよりもむしろ、この戦略は、大きなピークがさらに幅広くなり、近傍のピークと重なり、分離を妨げることになります。それでは、精製時間を伸ばしてもうまくいかない場合には、どのような戦略になるでしょうか。
私は、一つのアミノ酸が欠損した配列と目的の配列の分離を可能にしつつ、先ほど述べたピークの拡大問題を解決する方法として ステップグラジエントを用いること について以前少しだけ話したことがあります。ただし、この方法は、ソフトウェアへの追加サポートのヘルプがないと難しい場合があります。ステップグラジエントに代わる方法として、フォーカスグラジエントを用いることにしました。
私はまず、Biotage® Initiator+Alstra™で両親媒性ペプチド18Aを合成し、「スタンダード」なリニアグラジエントを用いて精製しました(図1)。
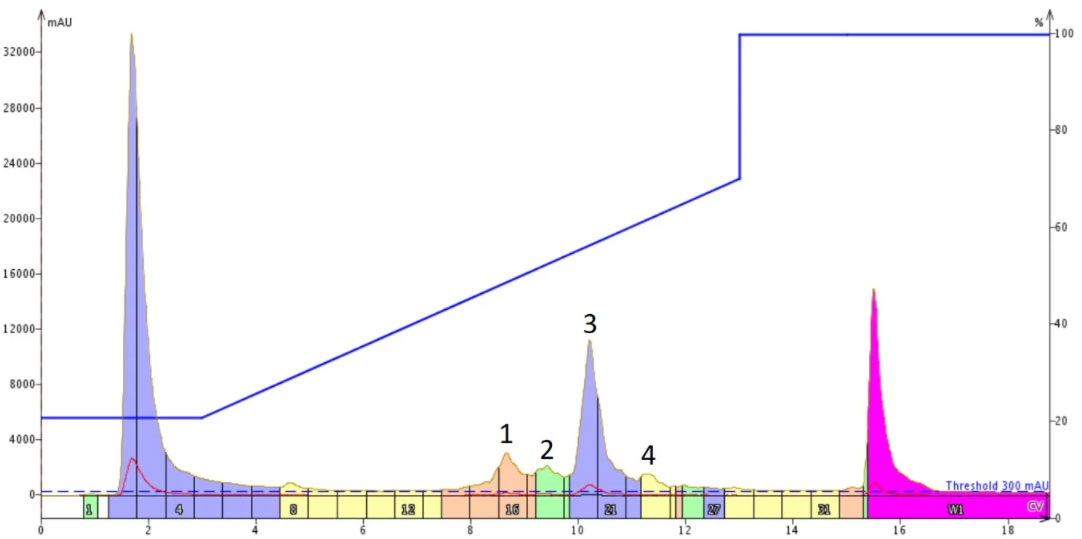
図 1: 標準的なリニアグラジエントを用いた 18A の精製。リニアグラジエントは、10 カラムボリュームにわたってアセトニトリルの濃度を20~70% へ変化させました。目的のペプチドは、ピーク3 に含まれます。
私のグラジエントの基準としているのは、10 カラムボリューム以上でアセトニトリル濃度を50% 変化させることです。ほとんどの場合、このアプローチは、ピーク幅の大きな拡大はなく、十分な純度で目的ペプチドを得ることができました。目的物のピークと不純物の3つのピークはかなり明確に認識され、互いにしっかり分離されています。得られたフラクションを濃縮させてHPLC分析を行うと、この精製条件ではまだ純度向上の余地があることがわかりました(図2)。
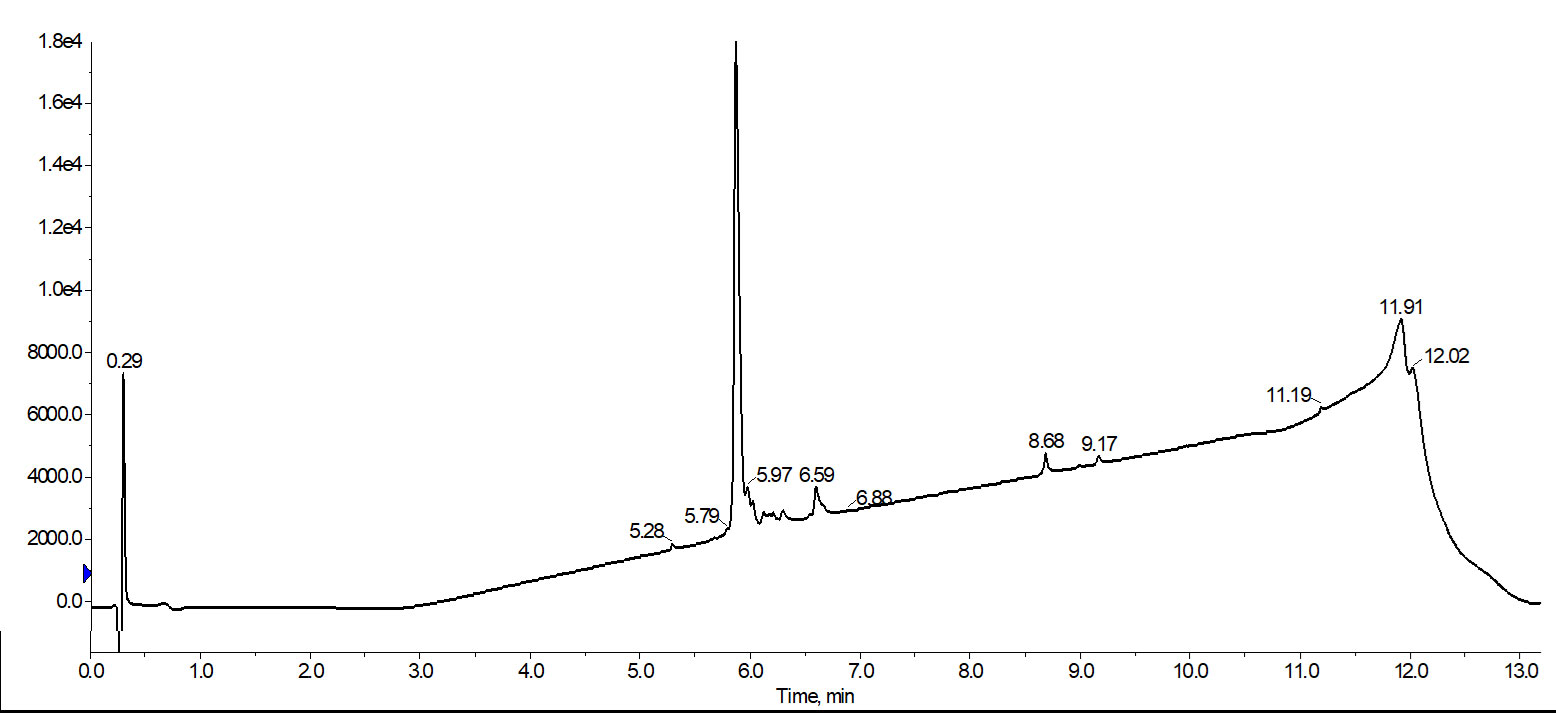
図 2: フォーカスグラジエントで精製した際の HPLC 分析クロマトグラム。18A は純度 83% で最終生成物が得られた。
得られた HPLC の結果からまだ純度を改善できると考え、私は目的のピークが溶出し始めるアセトニトリル濃度を近似することから始めました。この情報を用いて、フォーカスグラジエントを構築しました。フォーカスグラジエントは、移動相B アセトニトリル濃度の急激な変化させる領域と、目的のペプチドが溶出する付近で非常に浅い勾配を有する領域を有するグラジエントとして簡単に説明することができます。
私は、50%から 60% アセトニトリルのグラジエントに注目することにしました(図3)。これは当初使用したリニアグラジエントと比較すると濃度の傾きは非常に浅くなりますが(1CVあたり1% 対1CVあたり5%)、この浅い傾きの長さが以前に観察したピークの広がりを妨げるという仮説を立てました。
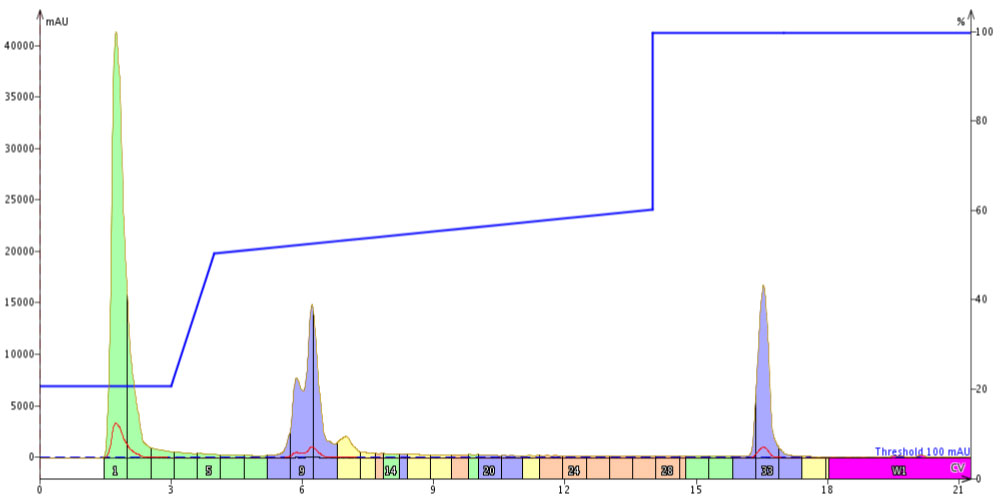
図 3: 50~60% アセトニトリルによるフォーカスグラジエントを用いた 18A の精製は、目的物近くの溶出不純物に対して高すぎる濃度で始まったため、目的生成物と同じタイミングで溶出したものもありました。
残念ながら、この最初の試みは、私が期待していたほどうまくいきませんでした。このグラジエントは純粋に目的のペプチドに焦点を当てていたので、初期に溶出した不純物を考慮しておらず、これら 3つのピークは目的物ピークに合流してしまいました。私はこの方法では結果は改善しないことが想定されたため、目的物の最終的な純度の評価は行いませんでした。
前回の結果を踏まえ、スタート地点を低くしたグラジエントで試してみました。目的のペプチドは明らかに 50%以上のアセトニトリルで溶出しますが、濃度勾配が浅いと、初期の不純物の分離を増やしながら、少し早く溶出するかもしれないと考えました。この仮説で、私は 10カラムボリュームにわたって40%から50%のアセトニトリルのグラジエントを構築しました(図4)。
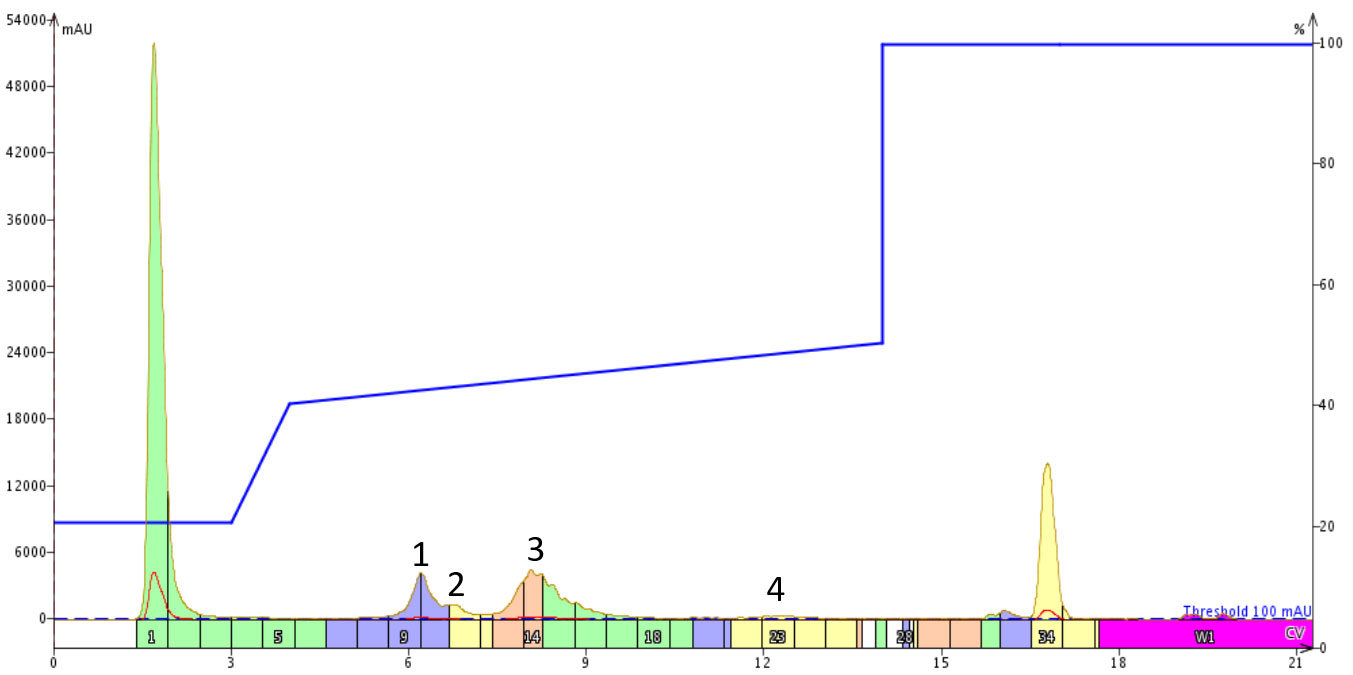
図 4: スタート地点の低いフォーカスグラジエントを用いた 18A の精製。3つの不純物ピークは、目的の生成物ピーク3からよく分離され、ピークの広がりは最小になっています。
グラジエントの傾きは前回の精製と同じでしたが、単に注目する領域をより低いアセトニトリル濃度で開始するだけで、目的の生成物ピークと 3つの有意な不純物の間の分解能が改善されました。グラジエントでアセトニトリルの濃度が上がるにつれて、後ろの溶出ピークは精製が進むにつれてピークが広がったのには注意するが必要あります。
私は、生成物が含まれているピークを回収して HPLC 分析を行いました。最初に実施した「スタンダード」なリニアグラジエントと比較した場合、ペプチドの最終的な純度が改善したことに、喜びを爆発させました。
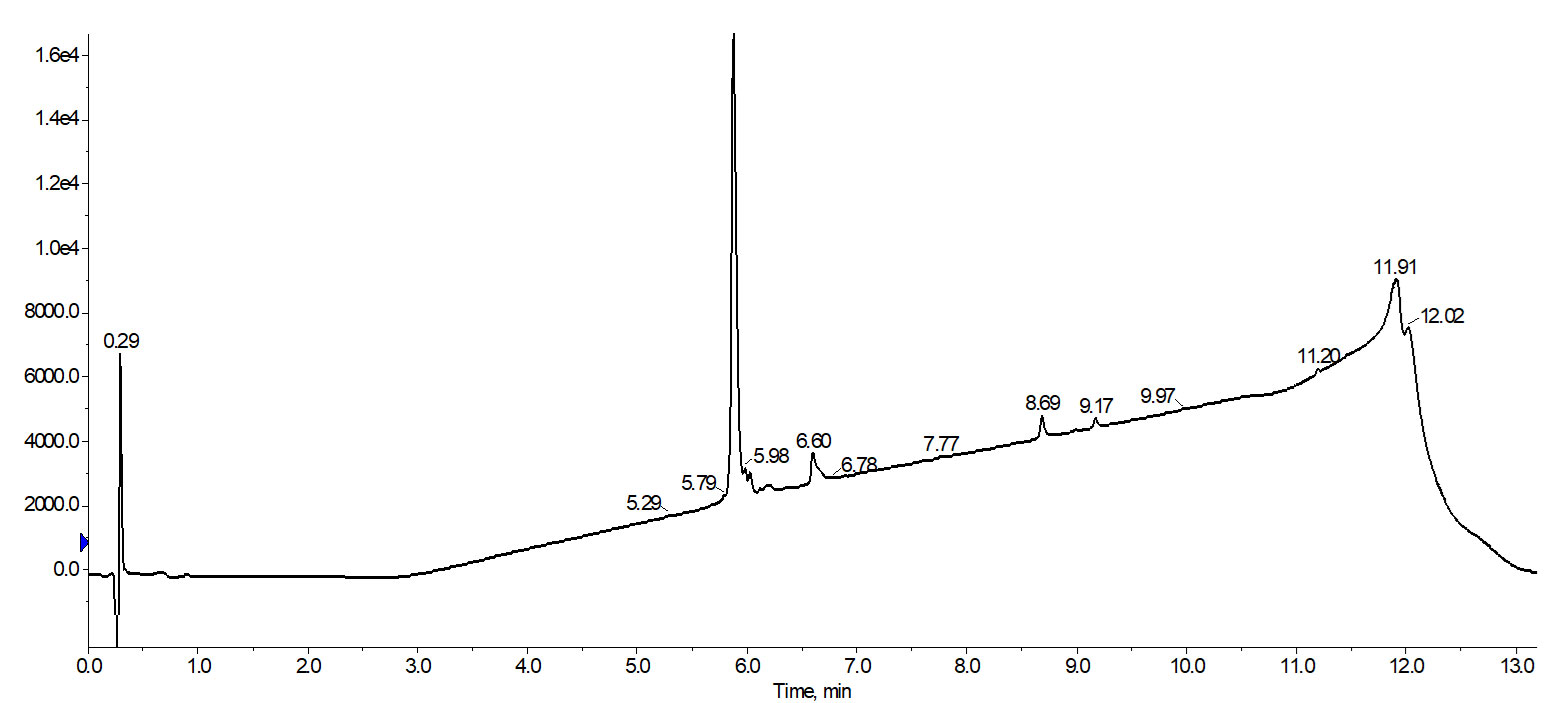
図 5: フォーカスグラジエントで精製して分取した 18A 分析 HPLC クロマトグラム。純度 88% で最終生成物が得られました。
フォーカスグラジエントを用いた精製は、観測されたピークの広がりが重要な懸念事項になるかもしれません。精製が進むにつれてピークの大きな広がりを避けるために、特に主要な不純物が目的のペプチドの前に溶出する場合、浅い勾配領域に別々のプログラムをすることを想像することができます。ペプチドの精製においてはまだまだ十分ではないようです。これからもフラッシュクロマトグラフィーにペプチド精製について研究を続けていきたいです。
フラッシュクロマトグラフィーでフォーカスグラジエントを使用した場合、他にどのような問題が生じたでしょうか?
フラッシュクロマトグラフィーがどのようにしてペプチド精製時間を短縮し、効果を発揮できるのか、興味がありますか? ホワイトペーパーも参考にしてください。
日本語化:2020年9月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(430KB, 2020年9月)