July 7, 2020
Elizabeth Denton
あなたは合成したペプチドを精製するために逆相HPLCの代わる方法を考えたことはありますか?馬鹿げた質問をしたかもしれません。そして、おそらく多くの人と同じように、私はバイオタージに入社して最初の日に、プロダクト・マネージャーが私に同じ質問をしたとき、私は文字通り笑っていたことを覚えています。
入社してから数年が経ち、その質問に対する私の答えは昔とは違います。このブログを読み進めてきたあなたがたにとっては、私がペプチド精製において逆相フラッシュクロマトグラフィーへ切り替えたことがわかるでしょう。本日の投稿では、私の考え方に大きな影響を与えた理由について紹介していきます。
大学院時代とその後、私はペプチド精製においてHPLCを好んで使用し、理解を深めていきました。私は高純度のペプチドを得るためにHPLC精製における速さと技術について学んでいました。しかし、ほとんどの週末においてHPLCの前で過ごす必要がありました。私の技術水準が向上しても、土曜の夕方を過ぎても作業を続けていました。廃液容器を空にする、移動相の溶液を調整する、などを実施する必要があるためです。しかし、もしそれらの作業が必要でなければどうだろうか。
研究グループあるいは研究室に新しい技術を導入する際には常に疑問点や懸念があり、これはどの場所でも同じ状況になるでしょう。私がHPLCの代替としてフラッシュクロマトグラフィーを使用することを最初に考えたとき、とりわけ頭に飛び込んだ疑問がいくつかありました。
私がこれまで実施してきた方法とどれほど違うだろうか。
純度95%以上のペプチドを得ることができるだろうか。
カラムにはどれくらいのペプチドをチャージできるだろうか。
フラッシュクロマトグラフィーは、標準的な分取用HPLCとは明らかに異なります。固定相の粒子サイズはより大きく、ペプチドケミストがこれまでHPLCで慣れてきた高分解能との違いを感じることになるかもしれません。しかし、より大きな粒子では、サンプルの負荷容量を大幅に増やすことが出来ます。これは、アプローチの異なる2種類の精製戦略を実施していきます( https://vimeo.com/195260422 )。
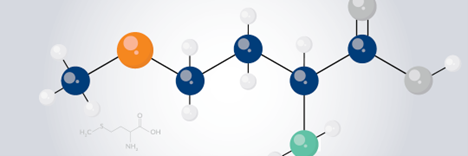
まず1つめの戦略は、比較的高純度でレジンから切断された粗ペプチドについての精製です。実際にフラッシュ精製を行うと、ペプチドを多量にチャージすることがき、目的物抽出後の洗浄を含めた全体の精製時間を短縮することが出来ました。低分子の残渣を取り除いたことにより、はるかに高価なHPLCカラムの負担および摩耗を減少させることが出来ました(図1)。
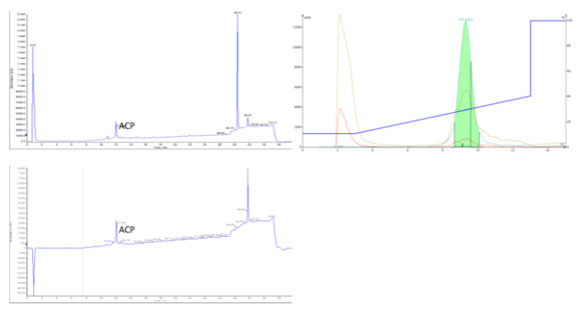
図 1: HPLC よりも比較的大きなカラムを使用しています。側鎖保護基の残渣(左上)を含む31%の純度で合成した ACP(65-74) を、10gの SNAP Bio C18 カートリッジを用いて300mgチャージして(右上)最終純度90%(下)で精製できました。この精製では、粗ペプチドはカラムメディア量に対して3%の負荷で実施しています。
もう1つの精製戦略は、フラッシュで比較的純度の低い粗ペプチドの租精製を実施してから、最終的な HPLC 精製を行うことです。2回精製するため作業効率が悪いように思われますが、実際には精製に要する時間は少なくなるかもしれません。フラッシュ精製装置を使用すると、カラムへのサンプルチャージ量が大きいため合成したペプチドすべてを1回の精製作業で実施でき、結果的には目的のペプチドサンプルを含む分取量を大幅に削減でき、最終的な純度を向上させることができます。その後、最終的なHPLC精製の作業においても、サンプルのロード回数を大幅に減らすことができます(図2)。
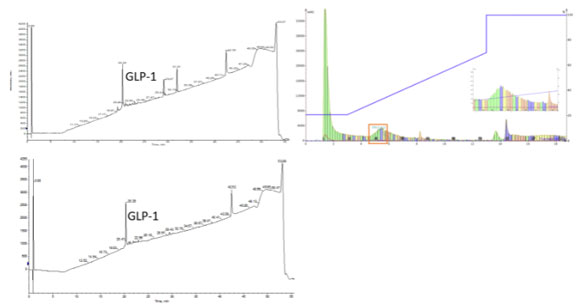
図 2: フラッシュによる租精製は HPLC の精製時間を短縮します。合成した GLP-1、37アミノ酸のペプチドを27%純度(左上)で合成しました。25gの SNAP Bio C18 カートリッジ(右上)を用いて150mgサンプルの精製を実施し、ペプチドが含まれる部品(オレンジボックス)を分取すると、最終純度87%(下)のサンプルが得られました。
では、この2つの戦略を実際にどのように比較するべきでしょうか。ますがフラッシュのみによる精製を検討してみました。合成した18残基の両親媒性ペプチドをフラッシュ精製すると、比較的租ペプチドの純度が高いこともあり、1回の精製作業で95%を超える純度を達成することができました。分取時の方法に大きな変更はなく、高い純度のペプチドを得ることができました(図3)。フラッシュ精製があなたのペプチド精鋭において有意義なものになると考えています。ペプチド精製において既存の枠にとらわれない考え方が必要な時がくるかもしれません。
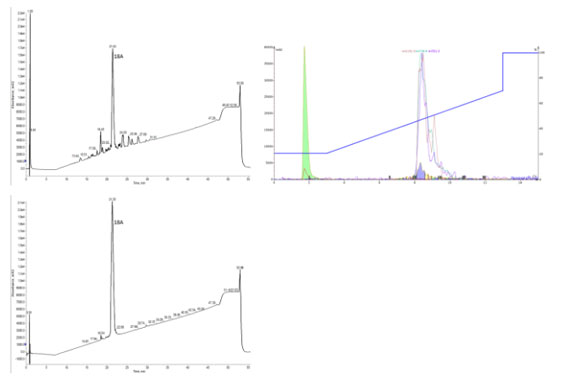
図 3: 18 アミノ酸の両親媒性ペプチドである 18A を69%の粗純度(左上)で合成し、SNAP Bio C18 (右上)を用いて精製し、最終純度>95%(下)で得られました。
私は、分取 HPLC の必要性をなくすことを目標に、多くのサンプルを負荷でき、高純度のペプチド精製を可能にするフラッシュ戦略の開発に取り組んできました( https://vimeo.com/280868382 )。検討を進めるうえで比較検討をしていないことに気付きました。フラッシュ精製と分取 HPLC による比較表を作成しました(表1)。
| High Pressure Liquid Chromatography (HPLC) | High Performance Flash Chromatography (HPFC) | Percent Difference | |
|---|---|---|---|
| Column Type | Phenomenex Gemini 5 um NX-C18 110A, 100 x 21.2 mm | Biotage SNAP Bio C18, 25 g | |
| Crude Loading (mg) | 150 | 150 | |
| Number of Injections | 4 | 1 | |
| Total peptide recovered (mg) | 33 | 33 | |
| Total Solvent A Consumed (mL) | 1777 | 1041 | 41.5% water savings |
| Total Solvent B Consumed (mL) | 1514 | 477 | 69.5% MeCN savings |
| Total Time for Purification | 160 min (4 x 40 min) | 27 min | 83% time savings |
表1
精製するペプチドの条件をそろえるため同じバッチ、同じスケールでペプチドを合成しました。チャージするサンプル量そろえ、フラッシュクロマトグラフィーまたは分取 HPLC を用いて精製を実施しました。フラッシュ精製は、分取 HPLC よりも精製時間を大幅に短縮することができ、より少ない溶媒量で実施することが出来ました。さらに純度においても分取 HPLC とそん色ない結果になりました(図4)。

図 4: ペプチド精製戦略として HPFC (高速フラッシュクロマトグラフィー;左)と HPLC (右)を用いたそれぞれのペプチドの分析 HPLC。
あなたは、あなた自身のペプチドの精製時間を短縮するために、新しい技術を試してみたいと思っていますか? フラッシュクロマトグラフィーによって可能になった短時間でのペプチド精製をぜひ体験してみてください。
日本語化:2020年9月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(2020年9月, 430KB)