April 28, 2019
Elizabeth Denton
ペプチド合成を改善するためには、いくつかの決まった戦略があります。まず、最初に考えられる案としては、配列内の特定のアミノ酸を導入するためにダブルカップリングを実施することです。これは、ペプチド配列全体でダブルカップリングを頻繁に実施する従来の室温合成戦略から変化したものです。
固相ペプチド合成においてカップリングとはアミノ酸を導入する反応を指しています。シングルカップリングはこの反応を1回、ダブルカップリングはもう1回(計2回)アミノ酸の導入反応を行うことです。アミノ酸は反応部位としてアミノ基へ導入されます。2回のカップリングを実施しても同じアミノ酸が連続して導入されないのは合成で使用するアミノ酸が Fmoc 保護されているからです。ダブルカップリングの利点は、2回目の反応で1回目の反応で残った未反応のアミノ基にアミノ酸が導入されることで、収率が向上することです。
以前の投稿 でダブルカップリングをマイクロウェーブ加熱と併用して、全体的にペプチドの純度を改善するシナリオについて簡単に述べました。今日の投稿では、ペプチド合成を改善するためにダブルカップリングが必要かどうかを、改めて深く検討していきます。
アミノ酸を導入する際にダブルカップリングが考えられる最も一般的な状況は、アルギニン を導入するときになります。ペプチド合成に使用するアルギニン試薬は、側鎖に グアニジン を含み、それを Pbf基 で保護した構造をもち、最も大きな立体障害をもつアミノ酸の1つになります。アルギニンは側鎖に相対的に反応性の高いアミノ基( pKa=9.04 )を含んでいるにもかかわらず、極端な立体構造のため、これまでアルギニンの残基のカップリングは困難であると考えられてきました。
立体障害の影響によるアルギンの導入の困難さ、この課題を克服するためにどの場面でダブルカップリングを用いるかを検討するため、私は、細胞膜透過性 の可能性をもつペプチドおよび 非ペプチドベース化合物 であり、一般的によく合成されているアルギニンが8個連続した配列である Octa-Arg を合成することにしました。
ChemMatrix® Rink amide レジン、カップリング試薬としては DIC と Oxyma を用いて、全自動ペプチド合成装置 Biotage® Initiator+Alstra™ で、私は初めて Octa-Arg を合成しました。最初の合成では、反応条件としてシングルカップリングを75℃で5分間反応させました。私はどのような結果になるかをまずは確かめたかったのです。驚いたことに、目的のペプチドは、欠損ペプチドなどの不純物を多く含まず、観測されました(図1)。
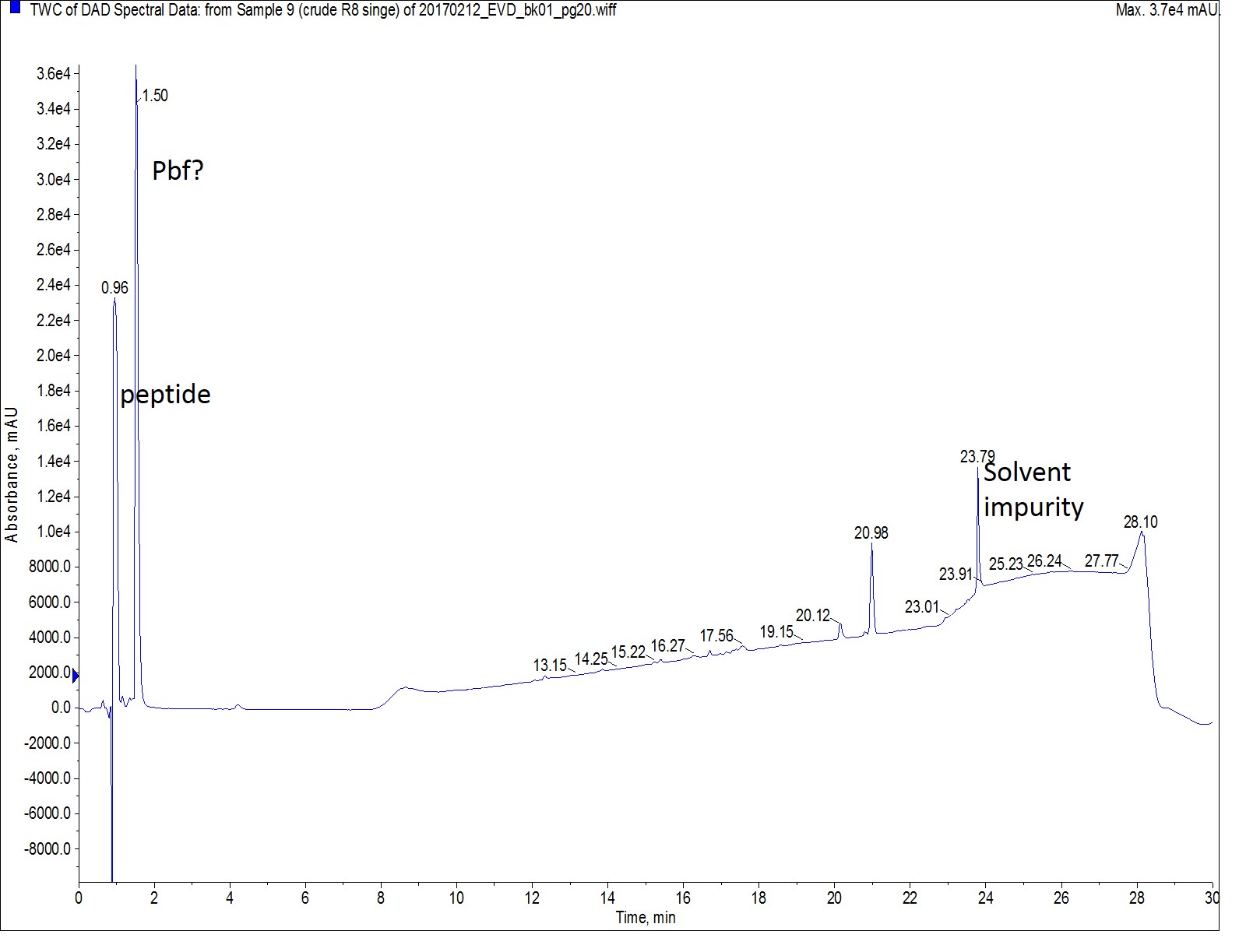
図 1: シングルカップリングで合成した Octa-Arg の分析 HPLC の UV スペクトル。グラジエントの後半に溶出されたペプチドはありませんでした。
Octa-Arg は多くの電荷を持っており、C18カラムを用いた 標準的な逆相条件 では、目的ペプチドを保持することは難しいことが示唆されました。HPLCクロマトグラムの最初のピークを質量スペクトルで分析すると、期待通りのイオン価と TFA が共に含んだ目的のペプチドを明確に示しました(図 2)。ただし、HPLC による精製条件の最適化について、後ほど議論したいと思います。
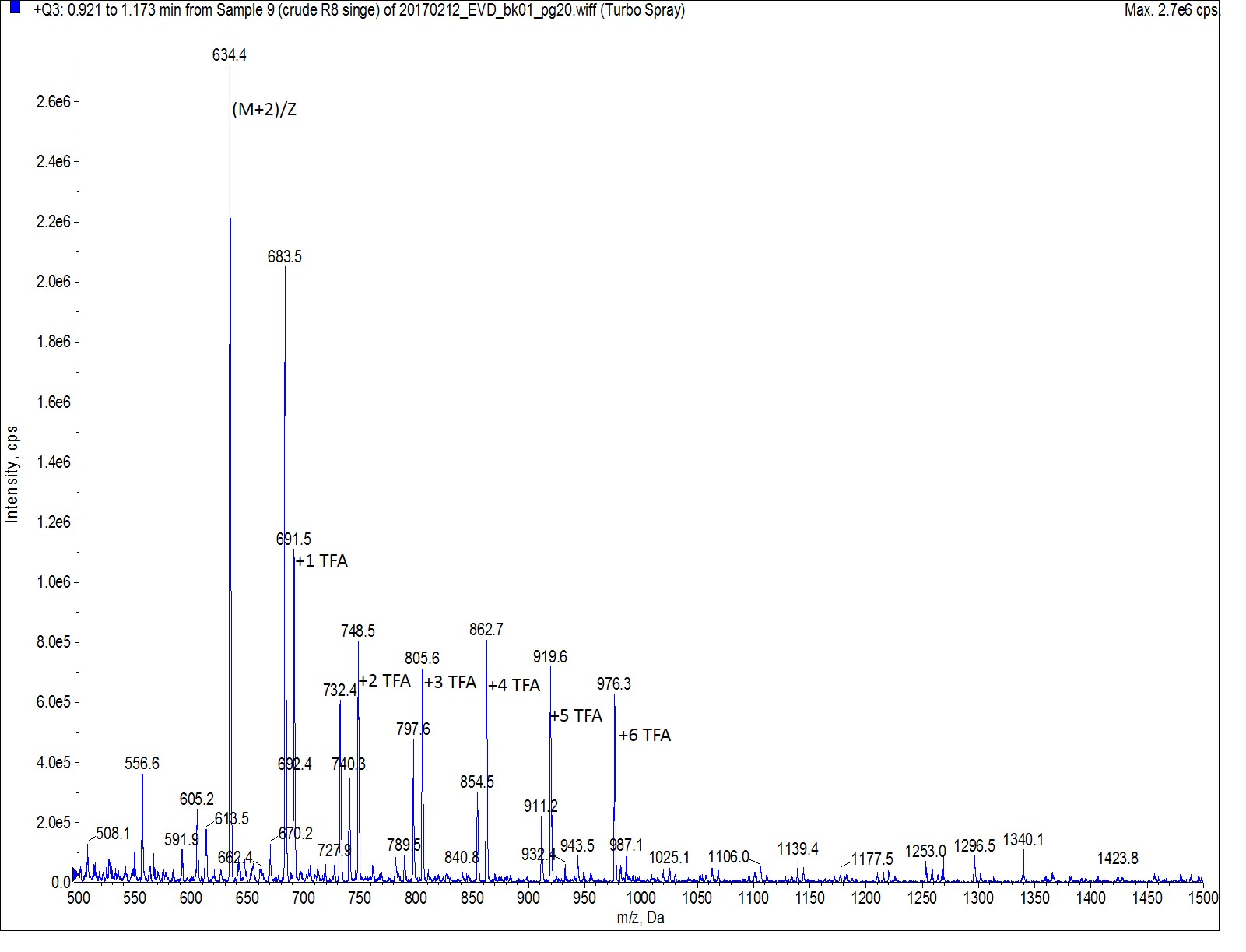
図 2: HPLCクロマトグラムのペプチドピークの質量スペクトル( retention time 0.96min )。目的のペプチドは、MW=634.5Da の2荷電のピークから判断しました。他のすべてのピークは、2荷電したペプチドに TFA イオンが添加されたことを示しています。それぞれのピークは TFA イオンの数で計算しています。
Octa-Arg の2回目の合成では、別の戦略を採用しました。カップリング試薬、スケール、当量を一定に保ちながら、今回はすべてのアルギニン導入でシングルカップリングを実施し、反応温度を50℃に下げ、反応時間を20分に延長しました。カップリング時間の延長は、試薬コストが懸念である場合に、室温合成においても導入困難なアミノ酸をカップリングする時にも使用される戦略であり、マイクロウェーブを利用したペプチド合成でも同様に使用されてきた戦略です。温度を下げ、時間を延長した方法での結果を示します(図 3)。
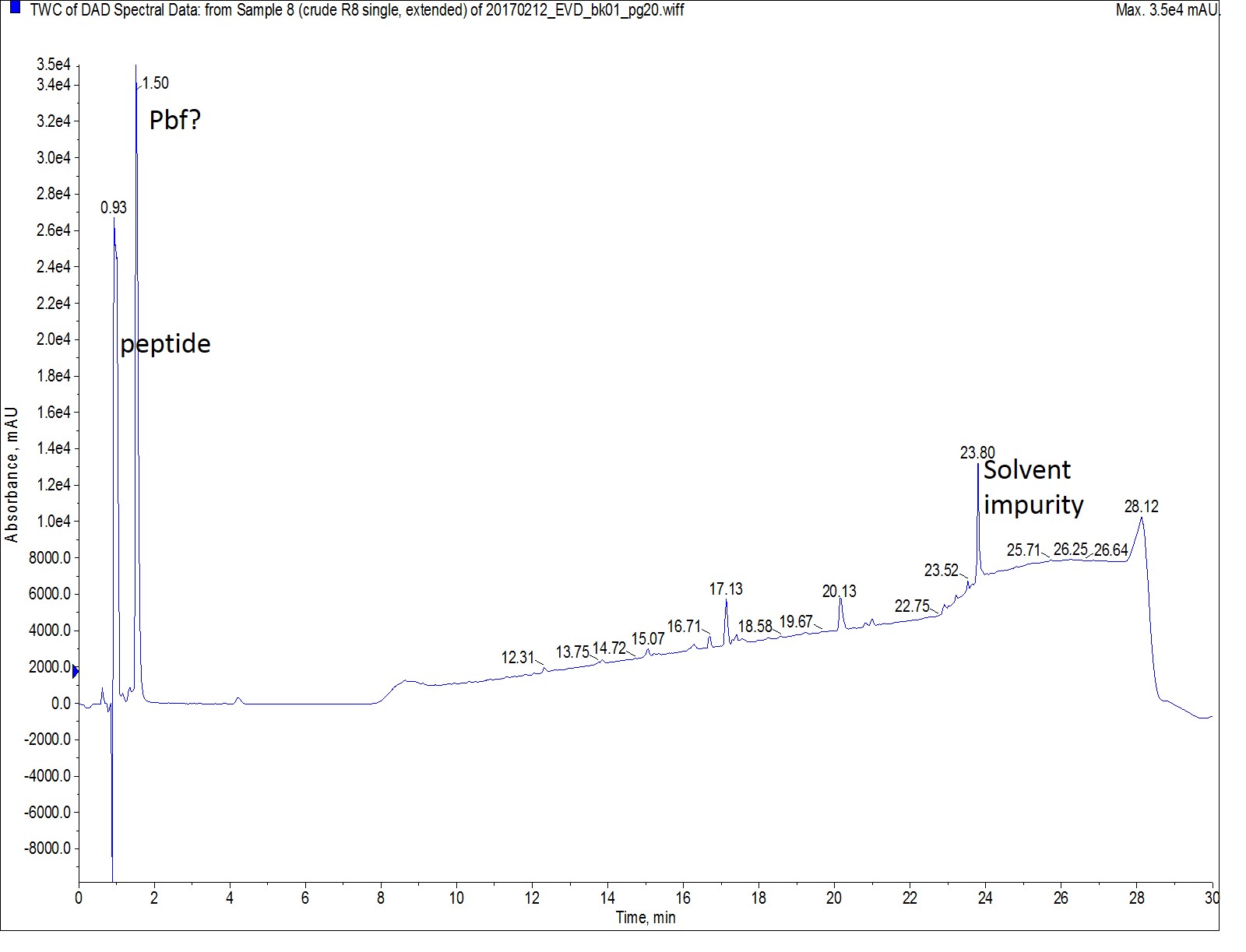
図 3: 時間を延長したシングルカップリングで合成した Octa-Arg の分析 HPLC の UV スペクトルのクロマトグラム。グラジエントの後半に溶出されたペプチドはありませんでした。主なペプチドピークの質量スペクトル( retention time=0.93 min )は図 2で観察されたものと同じになります。
最後に、私はペプチド配列のすべてのアミノ酸にダブルカップリングを用いて Octa-Arg を合成しました。以前の2回の合成とスケール、カップリング試薬、当量を一定に保ち、それぞれのカップリング反応は75℃で5分間反応させました。この合成で最も純度の高い粗ペプチドが得られる一方で、すべてダブルカップリングを実施しているため他の2回の合成よりもアミノ酸は2倍量消費していることになります。
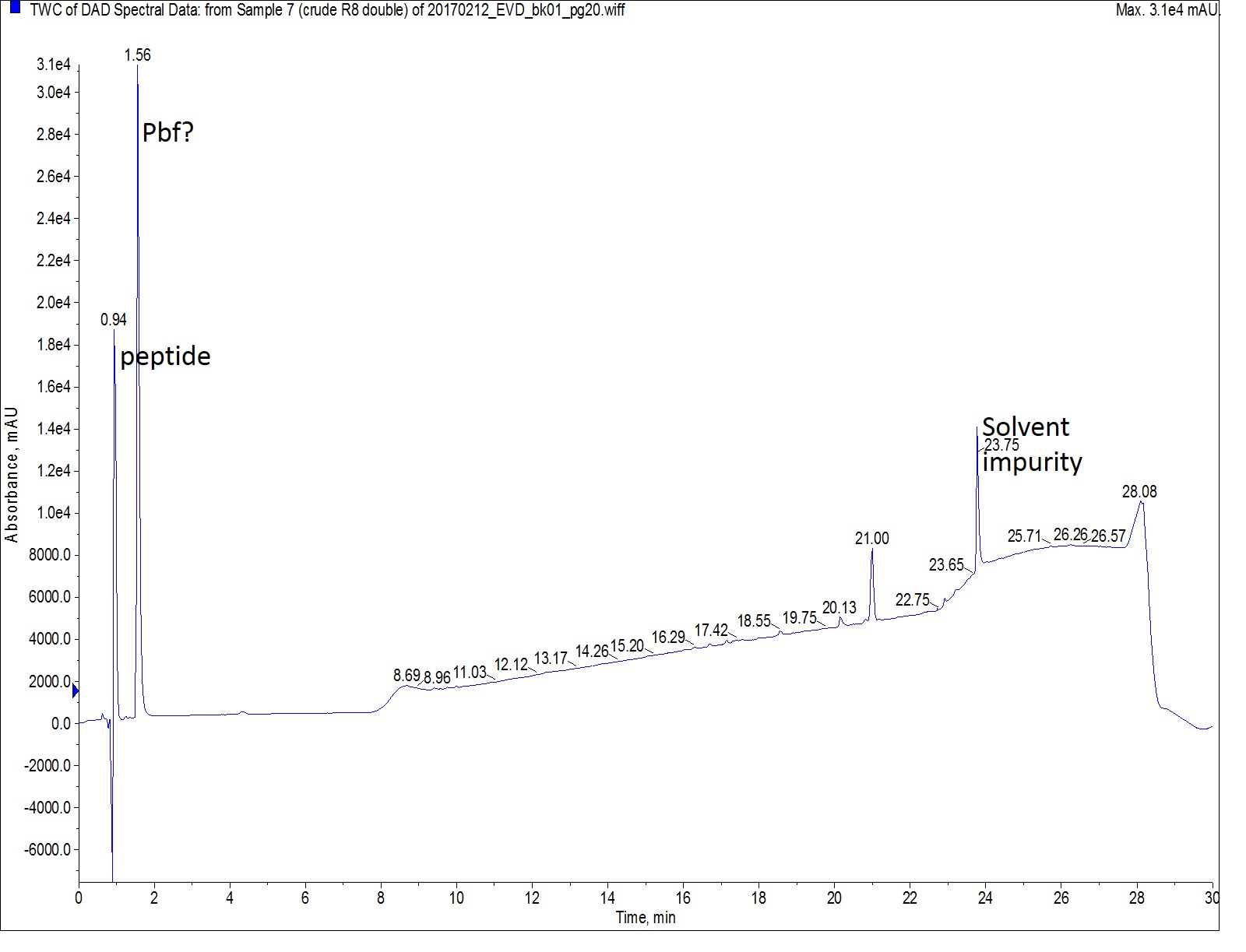
図 4: ダブルカップリングで合成した Octa-Arg の分析 HPLC のUVスペクトル。グラジエントの後半に溶出されたペプチドはありませんでした。主なペプチドピークの質量スペクトル( retention time=0.94 min )は図 2で観察されたものと同じになります。
私がこの時点で論じていないHPLCスペクトルのピークがあり、それは約1.5minで溶出するピークについてです。私は500Da以下の質量スペクトルは観測していません。質量スペクトルによりペプチドを同定する際は、分子量のカットオフ値を設定するのが普通であり、その値は目的分子量の半分程度になります。この1.5minで溶出するピークには強い UV 吸収があり、ペプチドを同定するための補助になるものではないかと推測しました。このピークに現時点で最も可能性が高いのは、アルギニンの保護基である Pbf 基になります。1) サンプル中にはアルギニンが8個含まれるため保護基として同量の Pbf 基が存在すること、2) Pbf のジヒドロベンゾフランが強いUV吸収があること、これら2つの重要な事実に基づいてこの結論を導き出しました。この結論を確認するために、私は低い分子量の範囲で解析を実施しているでしょう。
私はこの実験がもう少し興味深いものになることを願っていました。私は意図的に純度が低下するように行った「挑戦的な」合成は成功せず、思ったよりも純度が高くなりました。UVスペクトルをしっかり確認すると、ダブルカップリング戦略が合成ペプチドの純度を高めることが明らかになりました。シングルカップリングを用いて時間を延長して合成したペプチドの純度が最も低かったことは、私にとって最も興味深い結果になりました。これらのペプチド合成での結果ではあまり明白ではありませんが、ペプチド合成中に特にアルギニンのような側鎖が大きいアミノ酸が隣接している場合には、アルギニンの導入する場合はダブルカップリングすることを推奨します。
アルギニンを多く含むペプチドを合成するためにどのような方法を用いましたか?
ペプチド精製についても学びたいですか? ホワイトペーパーをご覧ください。
日本語化:2020年9月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(2020年9月, 400KB)