November 8, 2019
Elizabeth Denton
固相ペプチド合成用のレジンは、反応部位の官能基および素材の両方を変化することができるため、レジンから切り出したペプチドの状態を変化させることができます。これまでに、レジンのローディング量 が、ペプチド合成にどのような影響があるかを示してきました。
本日の投稿では、レジンの親水性と膨潤性の二つの性質が、ペプチド合成にどのように影響するかを紹介したいと思います。
ペプチド鎖が成長し続けるにつれて二次構造の形成や凝集の懸念が大きくなることを認識しておくことが大切です。ペプチドの粗収率を向上させる1つの方法は、低ローディング量のレジンを使用することです。他のレジン候補としては、架橋されたポリエチレングリコールポリマーで構成されたPEGレジンが、ポリスチレンポリマーよりも親水性と膨潤性が高いため、多くの注目を集めています(図1)。
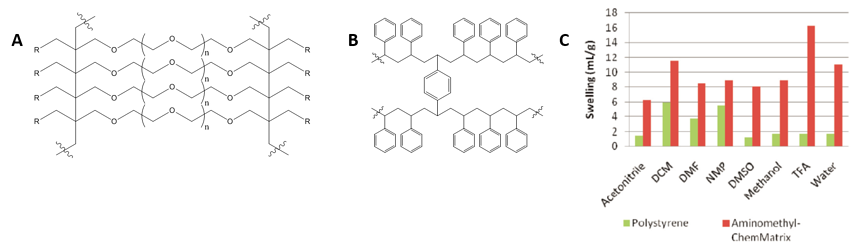
図 1: レジンの分子構造の対比 A) ポリエチレングリコールポリマー組成のChemMatrix® レジン B)一般的なポリスチレンポリマー組成のMerrifield型レジン C)固相ペプチド合成に一般的に使用される溶媒におけるレジン膨潤性の比較。
これらポリエチレングリコールとポリスチレンベースのレジンの違いをより徹底的に探るために、Garcia-Ramosらが発表したChemMatrix®レジンの論文 (ChemMatrix® for complex peptides and combinatorial chemistry) を参照しました。その論文で、彼らはすでに凝集傾向が知られている28残基のペプチドであるThermolysinα1を合成していましたが、合成結果は良くありませんでした。Garcia-Ramosらはこのペプチドを室温で各反応段階ごとにチェックしながらマニュアル合成していましたが、私はこのペプチドの合成を全自動ペプチド合成装置で実施することを検討しました。
私は、ポリスチレンレジンを用いてBiotage®Initiator+Alstra™でThermolysinを合成する準備をしました。ローディング量0.6mmol/gのRink amideレジンを選びました。前述したような低ローディング量のレジンではありませんが、このローディング量であれば後で説明するChemMatrix®レジンのローディング量と同程度になります。私は、カップリング試薬としてDICとOxyma Pureを使用し、反応条件としてシングルカップリングを75℃で5分間実施することにしました(図2)。
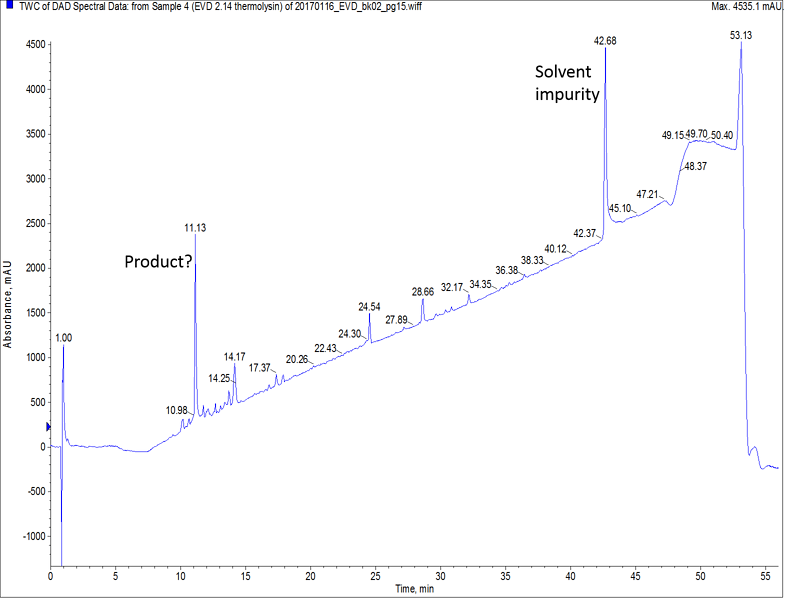
図 2: ポリスチレンレジンで合成されたThermolysinのHPLC解析結果
一見すると、得られたHPLCクロマトグラムは良い結果のように見えます。しかし、マススペクトルによる分析結果は次のようになりました。目的ペプチドのピークは確認できますが、非常に小さく、一方で最も大きく観測されたピークは、目的のペプチドよりも分子量が112小さいペプチドで、これはおそらく、イソロイシンが欠損したものだと考えられます(図3)。
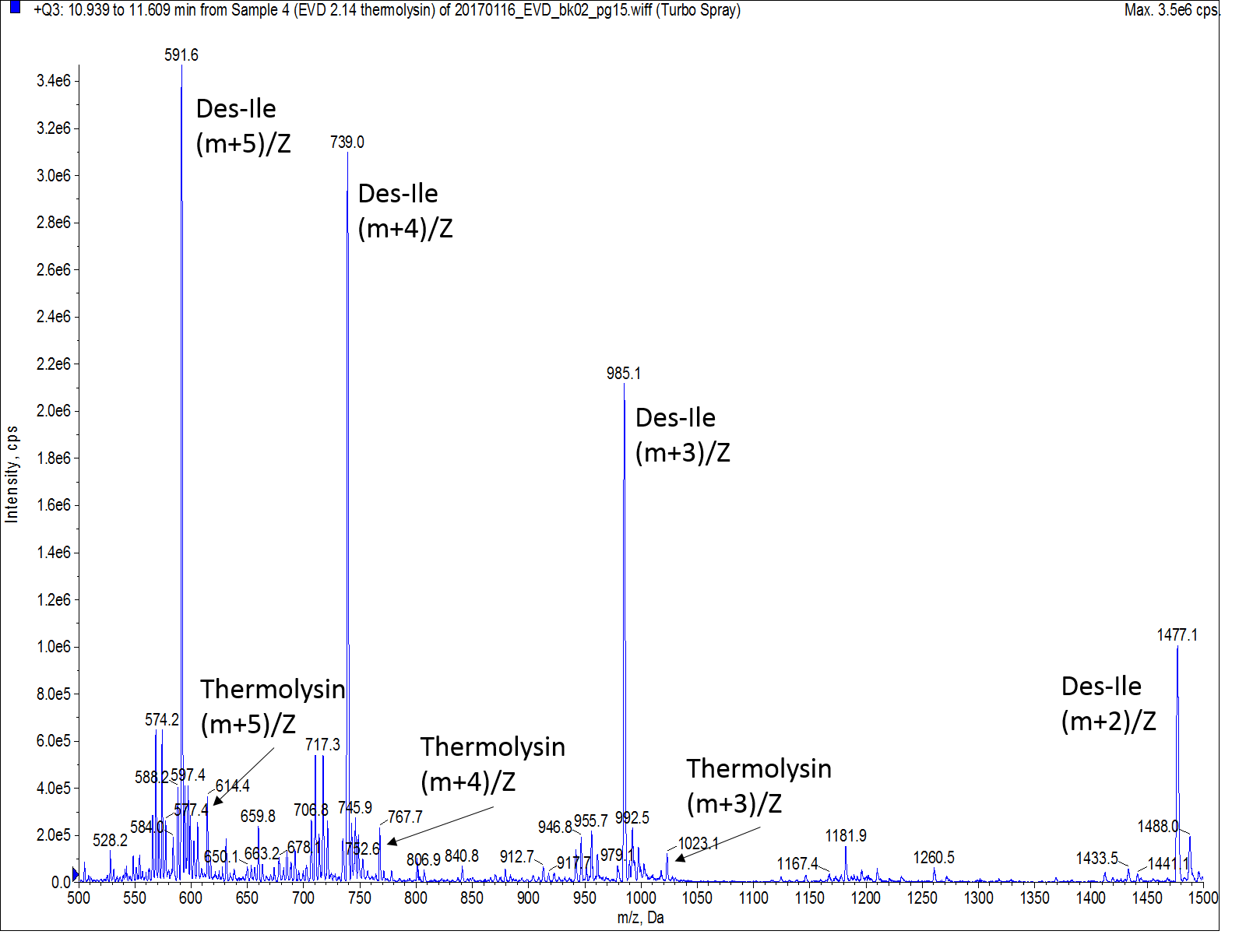
図 3: UVおよびTICで観測された主ピークの質量スペクトル。存在するほとんどの強大きなピークは、des-Ileつまりイソロイシンが欠損したものであり、完全なThermolysin ではないことを示唆しています。
次に、この合成結果を踏まえて、私は別のレジンを用いて合成を実施しました。最初の合成とまったく同じ反応操作とカップリング条件を用いました。今回、私は高い膨潤性と親水性をもつ ChemMatrix®レジンでローディング量 0.44mmol/g の Rink amide レジンを選びました。HPLC での UVスペクトルを確認すると少し心配になりました。その理由は、全体のクロマトグラムは良好に見えますが、メインペプチドピークが最初に評価した欠損ペプチドとほぼ同一の保持時間だったためです(図4)。
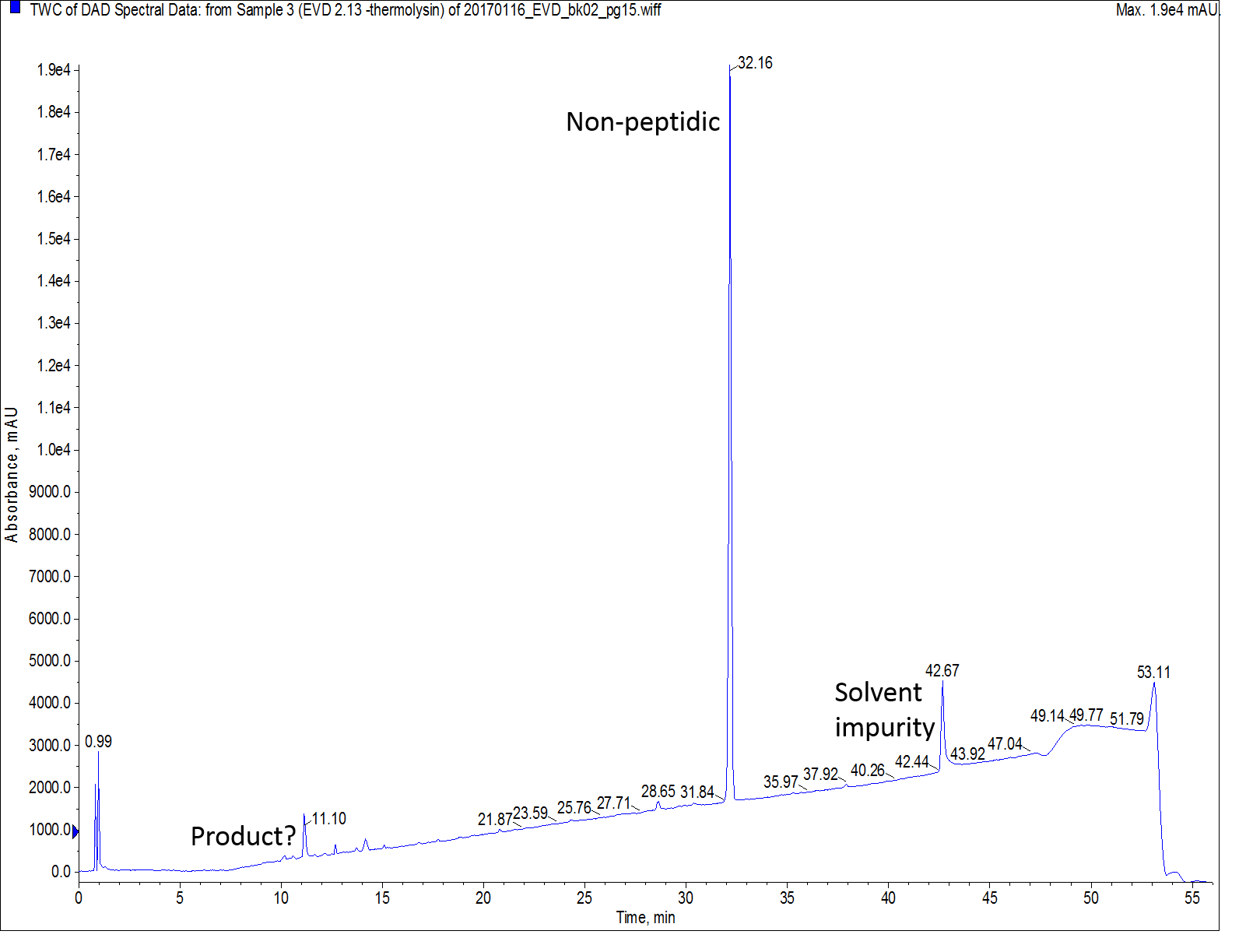
図 4: ChemMatrix®レジンで合成した Thermolysin の分析用HPLCクロマトグラムでの大きな不純物ピークは、サンプル中に残留した側鎖保護基の残渣である可能性が高いです。このときは、HPLC分析前に合成したペプチドをエーテル沈殿させませんでした。
質量スペクトルを測定すると、大きく検出されるイオンピークは目的物である完全長の Thermolysin ペプチドを含むことが分かりました(図5)。UVスペクトルを用いて、ペプチドではない不純物を除外した場合の粗ペプチドの純度は約65%と算出されました (不純物はペプチド切り出し溶液中の保護基の残渣である可能性が高いです)。
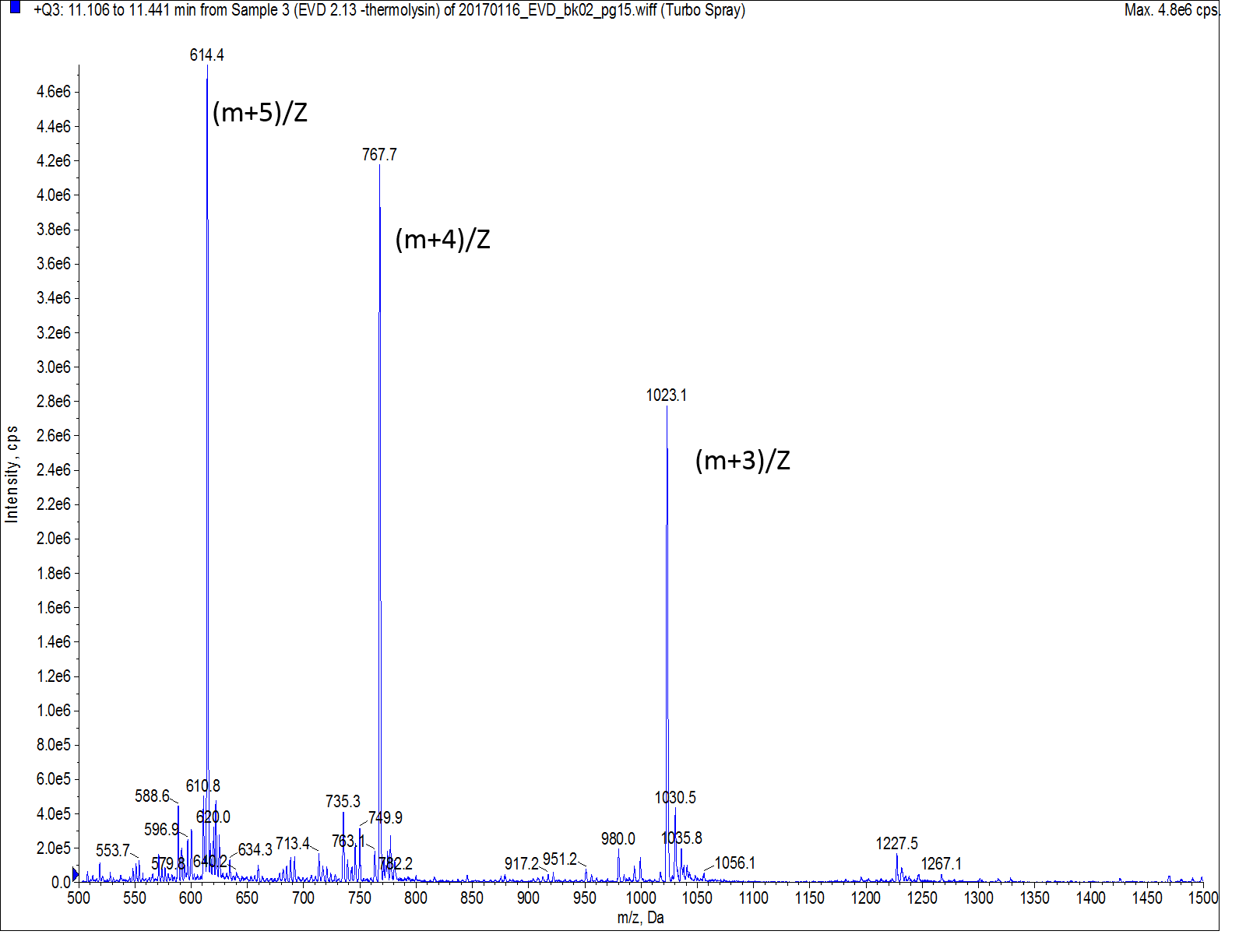
図 5: ChemMatrix®で合成された Thermolysin のUV および TIC で観測された主ピークの質量スペクトル。主要な3つのピークは、完全長の Thermolysin であることを示しました。
2つのレジンでは大きく結果が変わりました。このとき何が起きているのか検証してみました。私は二つの点を挙げたいと思います。1つは、ChemMatrix®レジンがポリスチレンレジンよりもはるかに大きく膨張することです。レジンが膨潤すると官能基や反応部位が空間的に遠ざかるように配置されるため、ペプチドが伸長してもペプチド間での凝集の可能性が減少します。2つ目の理由はポリマー自体の親水性です。ポリスチレン系レジンは非常に疎水性が高く、溶剤中にとどまるのではなく、ペプチドが溶媒中で伸長した状態でとどまっているのではなく、レジンそのものと相互作用していた状態になっています。PEGベースのレジンはエーテルで構成されているためポリスチレン系のレジンよりはるかに親水性が高く、伸長中のペプチド鎖とエーテル構造が立体反発さることで、ペプチド鎖の自由度が上がることによって合成の成功率を向上させていると推察されます。
最も重要なことは、これらの実験結果から、新しいペプチドを合成する際のレジン選択が重要な要因になるかを浮き彫りにしていることです。反応条件を最適化することなく、私はレジンを変えるだけで、既知の凝集を起こしやすく、比較的長いペプチドを合成することができました。今後は、ChemMatrix®、あるいは他の PEG で修飾された親水性の膨潤性が高いレジンを使用していきます。
合成が難しいペプチドを合成できたとき、どのようなレジンを使用しましたか?
ペプチドの精製についても学びたい方はホワイトペーパーをご覧ください。
日本語化:2020年9月
ウェブのみ一部修正:2024年8月
PDFファイルダウンロード(480KB, 2020年9月)