Bob Bickler
精製ブログでは、代表的な反応生成物の精製を示すことができるように、化合物を合成することが多くあります。その際、様々な合成条件の影響についても投稿することにしました。この投稿では、アミド合成における反応温度時間の影響について検討しました。
ご存じだと思いますが、化合物を合成する際には、スケール、反応溶媒、反応時間、反応温度など、いくつかのファクターが作用します。これらのファクターは、粗反応混合物の化学組成による生成物と副生成物に影響を与える可能性があり、実際に影響を与えています。
この投稿のために、私は、Biotage® Initiator+マイクロウェーブ合成装置を使用し、反応時間を変化させながら、100℃で酢酸エチル(EtOAc)中、無水イサト酸とベンジルアミンから2-アミノ-N-ベンジルベンズアミドを合成しました(図1)。反応時間は、2分、5分、10分、15分で実施しました。

図1:無水イサト酸とベンジルアミンを反応させると、2-アミノ-N-ベンジルベンズアミドが生成した。合成反応。反応温度、試薬濃度、反応溶媒は一定で、時間は2分から15分で実施した。
私が疑問に思ったのは、反応時間が生成する副生成物の数と、目標とする生成物の収率と純度に影響するとしたら、どのようなものだろうかという点にあります。反応時間を固定し、温度を変え、試薬の順序がこの反応に与える影響を評価した以前の研究では、生成物の収率は良かったのですが、いくつかの副生成物が生じていました。
私の最初の検証では、EtOAc中での反応時間が長くなるにつれて、反応混合溶液の色が濃くなっていきました(図2)。

図2:反応時間が長くなるにつれて反応混合物が濃くなった。
以前の実験から、順相でも逆相でも単独では完全に精製できず、白色であるべき生成物が褐色になってしまうことを知っていました。そこで、精製には両方の技術を用いていました。この順相フラッシュクロマトグラフィーと逆相フラッシュクロマトグラフィーの両方の使用は、直交型フラッシュクロマトグラフィーとして知られており、高価なPrep-HPLCを必要とせずに生成物の純度を最大化できる精製技術になります。
順相クロマトグラフィー精製
5グラムのBiotage® Sfär HCカラムを用い、ヘキサンと10%から40%のEtOAcを10カラム容量(CV)かけてグラジエントを作成して精製しました。これらのカラムは負荷容量がかなり高いので、各反応ごとに混合物全体をドライローディング(シリカ上)して精製しました。負荷量は454mgから586mgでした(表1)。かなり大きい負荷量だが、逆相フラッシュで目的化合物をよりよく精製できるように、親油性の副生成物を除去することが目的になります。
表1:様々な反応時間における反応収量。

順相クロマトグラフィーでは、2~5個の低極性副生成物と2個の大きな分解ピークが分離されました。反応時間が長くなるにつれて、副生成物の数は増加しました。その結果、目的のアミドは約10CVのシャープなピークと、それに続く副生成物を含む幅広いピークの両方に含まれていることがわかりました(図3)。これらのフラクションを濃縮し、秤量したところ、253mgから308mgの褐色結晶が得られました。興味深いことに、副生成物の数は反応時間と共に増加したが、混合物中の副生成物の総量は反応時間が長くなるにつれて減少し、反応時間が長くなるにつれて生成物の収率が高くなりました(表2)。
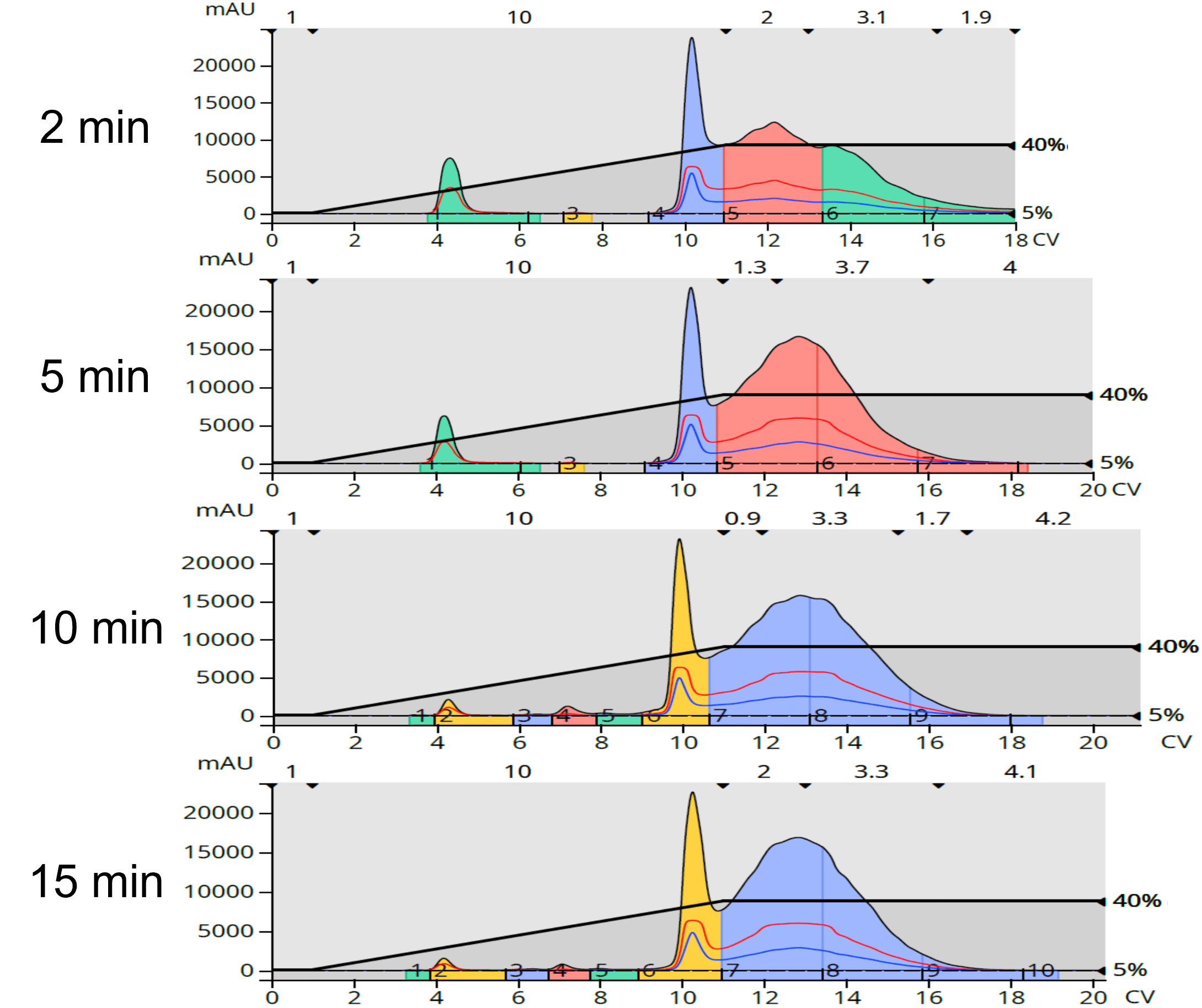
図3:順相フラッシュクロマトグラフィーによる反応混合物の精製では、反応時間が長くなるにつれて親油性不純物の数が増加した。
表2:順相フラッシュクロマトグラフィーによる精製後の反応収量と収率。

乾燥後、メタノールに再溶解し、各反応から得られた4つの生成物を含むフラクションを、12 gのBiotage® Sfär C18カラムと35-85% MeOH/H2Oグラジエントを用いたドライロードによる逆相フラッシュクロマトグラフィーを用いて再精製しました(図4)。逆相から精製された生成物の量は、副生成物をさらに除去した2回目の精製から予想されるように、順相からよりも少なくなりました(表3)。
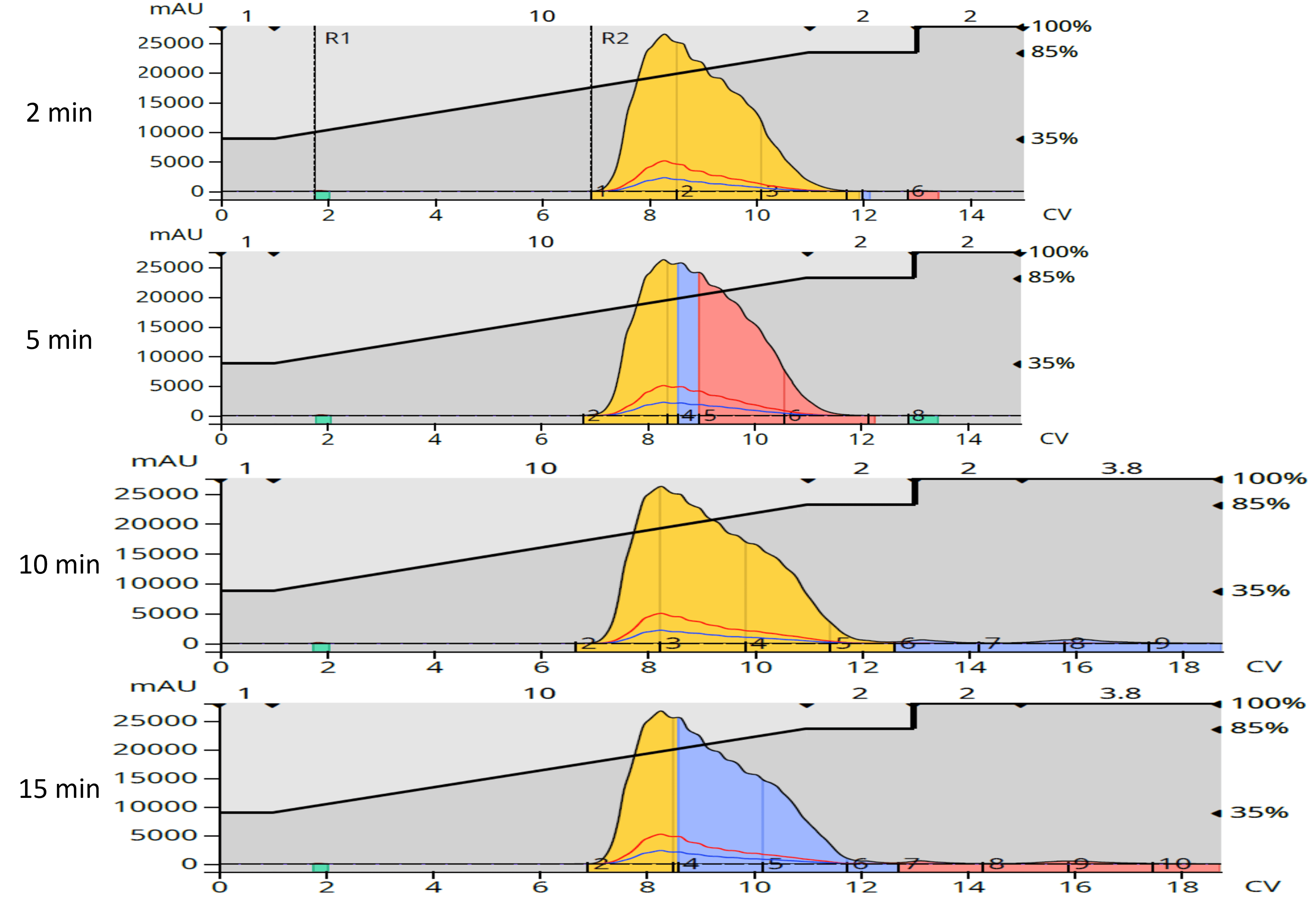
図4:順相クロマトグラフィーでの生成物を含むフラクションの逆相精製。
表3:逆相フラッシュ精製後の収量と収率。

アセトンに再溶解した後、各逆相精製フラクションをクロマトグラフィーで純度分析しました(図5)。
興味深いことがわかりました。生成物の純度は反応時間が短いほど高く(2分と5分)、これは上述の色の違いと相関しており、反応時間が短いほど最も親油性の(除去しやすい)副生成物が生成することを示す順相クロマトグラムと一致していました(表4)。
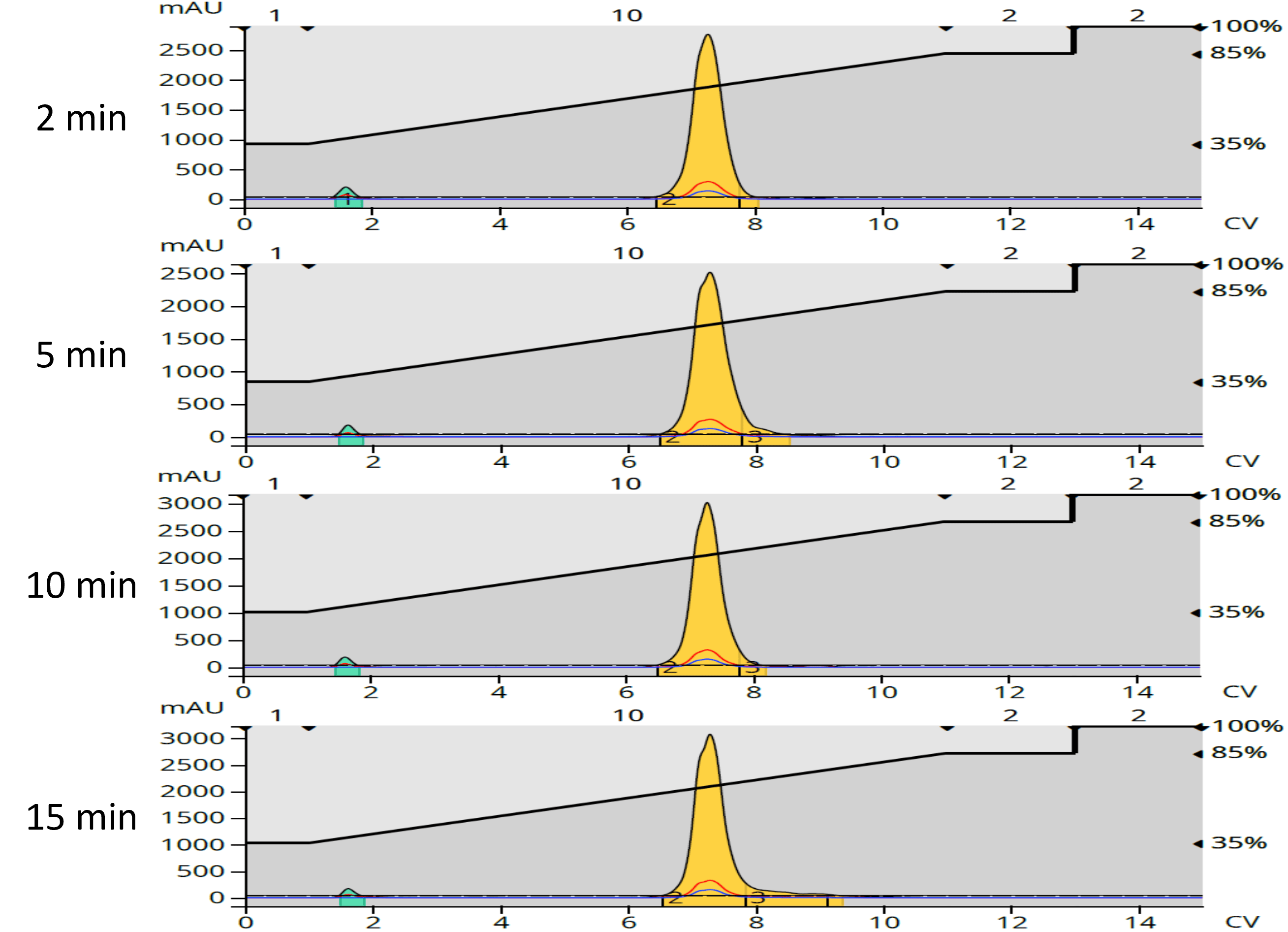
図5:逆相精製フラクションの純度クロマトグラム。純度は2分間の反応で最も良好だった。小さな緑色のピークは試料溶媒のアセトンである。
表4:逆相精製時の反応時間別の純度。

つまり、ここで見たように、反応時間は合成結果に影響を与える可能性があります。この例では、生成物の収量は時間と共に向上したが、純度は向上せず、反応時間が最も短かった場合に最良になりました。次の反応を行う時には反応時間も考慮する必要があります。
マイクロウェーブ反応の例についての詳細は、マイクロ波反応チュートリアルをダウンロードして下さい。