Bob Bickler
極性有機化合物の精製は非常に困難な場合があります。以前の投稿で、逆相フラッシュクロマトグラフィーを使って、イオン化可能な化合物やイオン性化合物を保持し、精製することについて述べました。私の同僚であるElizabeth Denton博士も、非常に極性の高いペプチドの精製に関するブログを投稿しています。しかし、逆相でいくら努力しても成功しないこともあります。そんな時、あなたはどうしますか?
この投稿では、HILIC(親水性相互作用クロマトグラフィー)の一種である水性溶媒を用いた順相フラッシュクロマトグラフィーを使って、逆相メディアでは十分に保持されない化合物を精製する方法について説明します。
順相クロマトグラフィーはシリカと有機溶媒だけではありません。極性結合相など、他の順相メディアも存在します。そのようなメディアの例として、プロピルアミン結合シリカがあります。
このメディアは、有機アミンを精製する際に、化合物とシリカの相互作用を最小限に抑える「塩基シールド」を形成するだけでなく、イオン交換を行うことができるアミン官能基を持つ非常にユニークなメディアです。しかしこの記事では、このメディアが炭水化物のような極性の高い水溶性化合物の保持と分離にどのように使用できるかについてお話したいと思います。
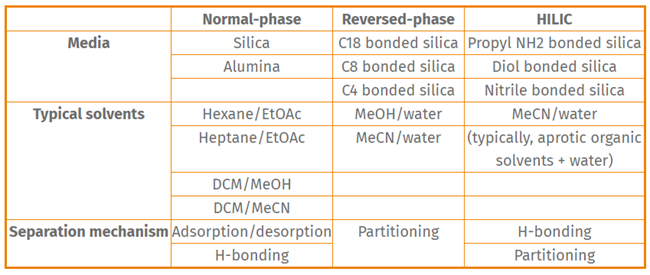
糖類はクロマトグラフィーで精製するのが特に難しい場合があります。極性の高い化合物は、逆相クロマトグラフィーで可能なパーティショニングを最小限に抑えます。単糖は通常、カラムのボイドボリュームで溶出しますが、それ以上の糖類は保持されることがあります。逆相における分配から親水性相互作用におけるH-結合(この場合)へと分離メカニズムを反転させることで、アミン結合シリカの使用は精製戦略として成功する可能性があります。このタイプの分離には興味深い工夫があります。逆相溶媒を使用しますが、強溶媒としてアセトニトリル(あるいはメタノール)ではなく水を使用します!その結果、極性の高い化合物がよく保持され、粗混合物のクロマトグラフィー分離が可能になります。下の表は、HILICと逆相および順相クロマトグラフィーの違いをまとめたものです。
サッカリンは人工甘味料Sweet & Low®に含まれ、ブドウ糖とステアリン酸カルシウムと結合しています。最近、あるプロジェクトで炭水化物の精製を行う機会がありました。このプロジェクトでは、フラッシュグレードのメディアで糖と糖代替物を分離する能力を調べました。私は、台所にある(あるいはほとんどのレストランにある)一般的なもの、すなわちテーブルシュガー(スクロース)と人工甘味料(サッカリン)を手に取りました。
炭水化物は紫外線を透過するので、化合物を検出するために質量検出器(ESIまたはエレクトロスプレーイオン化源を備えたIsolera Dalton® 2000)を使いました。pHの最適化を追加することなく、最も効果的であったメソッドは、Biotage ISOLUTE® NH2メディアを充填したBiotage® SNAPカートリッジで、アセトニトリル中20%から40%の水を素早くグラジエントするメソッドでした(図1)。このような極性溶媒と極性固定相の組み合わせは、HILIC(親水性相互作用クロマトグラフィー)と呼ばれることがあります。
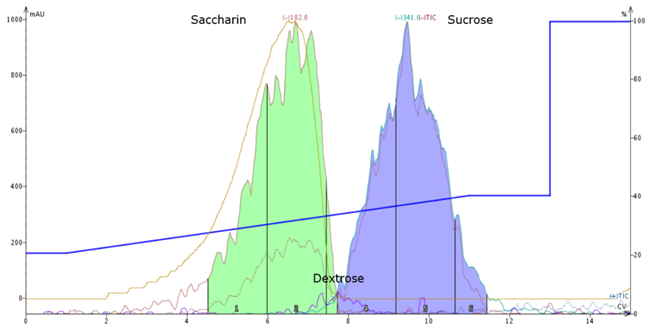
図1. ネガティブm/zモードでのESI質量検出を用いたHILIC、スクロースと混合したSweet and Low。サッカリン(m/z 182)は部分的にイオン化しているため、わずかに前に出ています。スクロース(m/z 341)はきれいに保持され、サッカリンからうまく分離しています。デキストロース(m/z 179)はイオン化が不十分ですが、検出されています(2つのメインピークの間の紫色のトレース)。
糖類の分離にアミン結合シリカを使用する場合、極性の固定相と相互作用するヒドロキシル基の数によって保持が異なる傾向があります。小さな糖は、より多くのヒドロキシル基を含む大きな糖よりも早く溶出します。上の例では、単糖であるデキストロースは二糖であるスクロースよりわずかに早く溶出します。疎水性の高いサッカリンはさらに早く溶出します。
フラッシュクロマトグラフィーについて詳しく学ぶには、ホワイトペーパーを下記ボタンからご覧ください。
日本語化:2023年7月
ウェブのみ一部修正:2024年9月
PDFファイルダウンロード(616KB, 2023年7月)