DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25
Nature(https://doi.org/10.1038/s41586-020-2394-6 )
Linbin Yang et. al
11 June 2020
ライフサイエンスに関連するトピックを毎月お届け致します。9 回目となる今月は好中球がバクテリアを捕えるのに放つ「網」と「がんの転移」の関係について紹介したいと思います。好中球と聞くと「わたしたちの体内をパトロールしている細胞」とイメージする方が多いと思います。しかしながら、この「網」に含まれる DNA が「がんの転移」をうながす現象が報告されています。これを指標にすることで従来の「肝臓がんの早期検出マーカー」より約 2 週間もはやく検出できうることを今回ご紹介する論文では示しております。
好中球は主に生体内に侵入してきたバクテリアなどに走化性反応を示し、食べる(貪食)ことで殺菌をおこない、わたしたちの体を「感染」から防ぐ役割を果たしています。好中球は血管内を流れているときには前後左右の極性をもたず、転がるように移動しています(図1上左)が、誘引因子を感知すると血管内皮細胞上に接着し、細胞内にて特定の分子の極性がうまれ前後軸がつくられます。このように走化性反応は、免疫応答のみならず傷の治癒、がん細胞の転移や血管新生とわたしたちの体の恒常性に深くかかわります。
好中球は「食べられる」以上に相手がおおいときは、彼らの命と引き換えに自身を内部から破裂させ網(NETs; Neutrophil Extracellular Traps)を発射しバクテリアなどを捕獲・殺菌する能力をもつことが15年ほど前にみつかりました(図1上中央と図2下)。これには DNA、ヒストンや消化酵素が含まれています。
この死の過程は *ネクローシスとアポトーシス とは異なるタイプの細胞死ということで、**NETosis と名づけられています。NETs は通常の感染症でも細菌撃退の方法として活躍していますが「がん細胞」の転移を誘発することもマウスを利用した研究から示唆されていました。
*ネクローシスとアポトーシス:アポトーシスは、厳密な分子メカニズムによりコントロールされている。一方のネクローシスは、細胞がダメージを受けることで誘導される現象であり、分子メカニズムを伴わない細胞死である。両者が「朽ちていく」過程には明確な違いがみられる。
**NETosis:好中球 NETosis の誘導には活性酸素種(ROS)の産生が重要であることが報告されています。NETosis では、① 脱分葉が起こり核膜が消失し、それの成分が細胞質全体に広がります(図2上段左)、② ライソソーム等の細胞内小器官が消失し、細胞が膨潤します(図2上段中央)、③ 細胞膜が破れ細胞内の物質が外部に放出されます(図2上段右)。
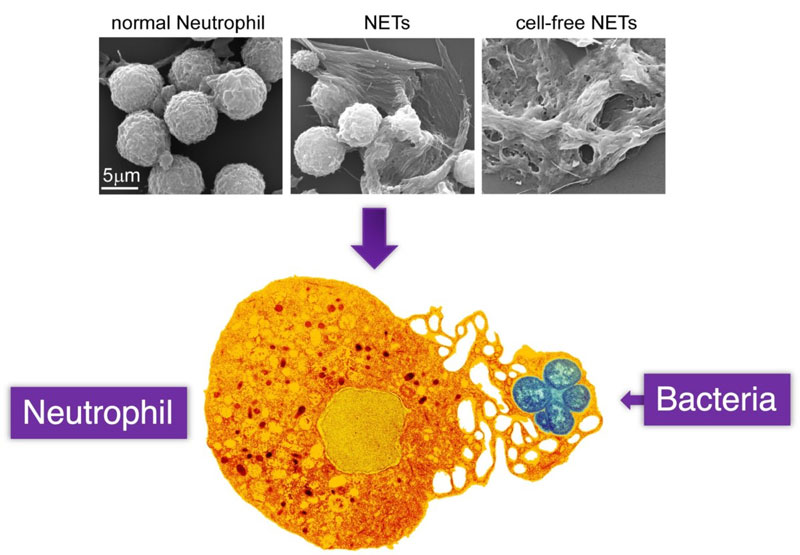
図1: Efficient Neutrophil Extracellular Trap Induction Requires Mobilization of Both Intracellular and Extracellular Calcium Pools and Is Modulated by Cyclosporine A
PLOS ONE(https://doi.org/10.1371/journal.pone.0097088)
Anurag et. al
12 May 2014
Figure. 1より抜粋(一部改変)
図1の解説;好中球は体内に侵入したバクテリアの位置情報を正確にしり、そこへ迅速にむかい始末する防御機能をもつ。
好中球は外部からの刺激に反応し、どのように自分自身のふる舞いを『ランダムなうごきから方向性のあるうごき』へと切りかえているのか。この『方向性のあるうごき』を走化性反応といい、細胞が誘引物質を感知し、その方向へ遊走していくことです(上)。
好中球が NETs を放出しバクテリアを捉えている様子(下)。
この NETs には 2 パターンあることが知られています。ひとつは「自分の命」と引き換えにする 放出タイプです。もうひとつは「生きたまま」蜘蛛のように放出するタイプです。
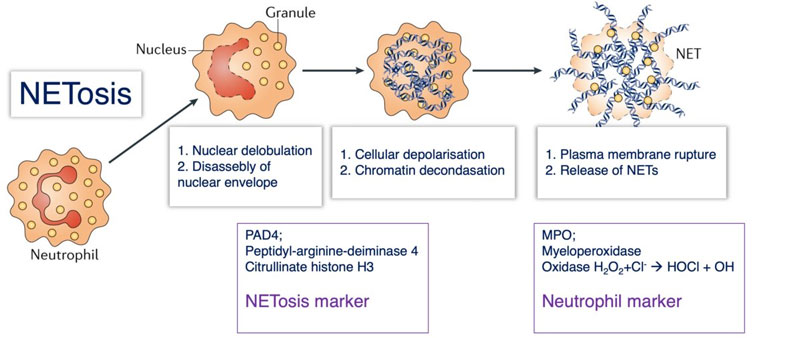
図2:Neutrophil extracellular traps in immunity and disease
Nature Reviews Immunology(https://doi.org/10.1038/nri.2017.105)
Papayannopoulos
09 October 2017
Figure. 1より抜粋(一部改変)
図2の解説;Web-like クロマチン構造として知られる NETs の形成過程
健常状態の好中球(左)。NETosis が誘導されると脱分葉が起こり、核膜が消失したのち、それらの成分が細胞質全体に広がる(上段左)。つづいてライソソーム等の細胞内小器官が消失し、細胞が膨潤する(上段中央)。さいごに細胞膜が破れ、細胞内の物質が外部に放出される(上段右)。
ここで問題提起となります。「がん細胞」が NETs に走化性反応を示すのはわかっていましたが、どのようなメカニズムで「がん細胞」の転移をうながしているでしょうか?
この論文が提示する「がん細胞」の転移のメカニズムです。① 好中球が血中で肝臓から流出する NET-DNA を受容体 CCDC25 の細胞外 N 末端で感知すると細胞内 C 末端に ILK をよびこみます。 ② ß-parvin-RAC1-CDC42 シグナル伝達経路を活性化し細胞骨格の再編成をうながします。③ がん細胞は肝臓へ転移するため、走化性運動をはじめます(図3)。
筆者らは血中の NET-DNA の量を調べることで、乳がんや大腸がんの肝臓への転移を早期検出が可能となり、予後不良を改善することができると主張しております。
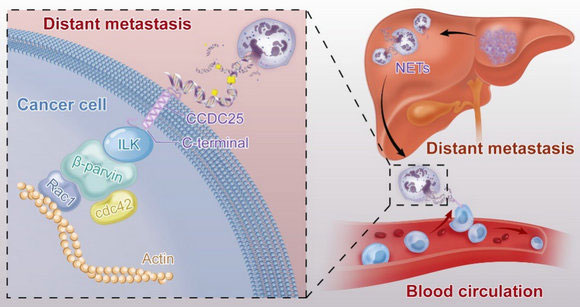
図3: DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25
Nature(https://doi.org/10.1038/s41586-020-2394-6)
Linbin Yang et. al
11 June 2020
Extended Data. Figure. 10より抜粋
図3の解説;好中球が放つ NETs に含まれる DNA が「がん細胞」表面のタンパク質と相互作用することで走化性因子としてはたらく
① 好中球が血中で肝臓から流出する NET-DNA を受容体 CCDC25 の細胞外 N 末端で感知すると細胞内 C 末端に ILK をよびおこす(左)。 ② ß-parvin-RAC1-CDC42 シグナル伝達経路を活性化し細胞骨格の再編成をうながす(左)。③ がん細胞は肝臓へ転移するため、走化性運動をはじめる(右)。
細胞の新たなメカニズムを紐解き医薬開発へと結びつけるため、世界中の研究員たちは莫大な数の…、
① プラスミド DNA の精製
② タンパク質の発現や精製
③ 細胞内での評価
上記の3つを継続的に「ひとつひとつ」入念におこなう必要があります。特に下記の2つが大事になります…、
- プラスミド DNA の精製 → 細胞への transfection → タンパク質の発現
- 細胞や動物での評価
これらを「ひとつずつ」マニュアルで検証していくと莫大な労力、時間や資金を要します。それゆえに「同じ条件」で「再現性高く」これらのステップをおこなうには、ロボットによるオートメーションが求められてくるでしょう。
このような要求に応えられるよう、わたしたち Biotage®はオートメーションに適した製品を数おおく提供しています。
① PhyTip®カラムはタンパク質、抗体やウィルスの精製に適した製品であり、さまざまなアプリケーションに対応しているので、主要なリキッド・ハンドラーに搭載することができます。
② PhyPrep®は自動でマキシ〜ギガ・スケールのプラスミド DNA を精製するロボットです。得られる産物はエンドトキシン・フリーですので、そのまま transfection に利用できます。
Biotage®は「Lab オートメーション」を推しすすめ、研究者をルーティンから解放することで「貴重な時間」を提供しています。
参考文献
- DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25
Nature(https://doi.org/10.1038/s41586-020-2394-6)
Linbin Yang et. al
11 June 2020 - Efficient Neutrophil Extracellular Trap Induction Requires Mobilization of Both Intracellular and Extracellular Calcium Pools and Is Modulated by Cyclosporine A
PLOS ONE(https://doi.org/10.1371/journal.pone.0097088)
Anurag et. al
12 May 2014Poster No. 129 - Neutrophil extracellular traps in immunity and disease
Nature Reviews Immunology(https://doi.org/10.1038/nri.2017.105)
Papayannopoulos
09 October 2017