Single domain antibodies-minimalist binders for maximal therapeutic efficacy
Singh Biotechnology. (http://www.singhbiotechnology.com)
Biopharma Dealmakers (Biopharm Deal)
September 2021 B36-37
ライフサイエンスに関連するトピックを毎月お届け致します。4 回目となる今月は進化する「抗体医薬」をテーマに「nanobody」について紹介したいと思います。今回のおはなしの中心は、今までの抗体ではアプローチが困難であった細胞内や脳関門へアクセス可能な「次世代」の抗体医薬です。そのターゲットは、おおくの「がん」で変異や過剰発現がみつかっている KRAS と STAT です。
Nanobody(2.5 nm)はアルパカやラマなどのラクダ科の動物に実在する特殊な抗体です。名前の由来からわかるように抗体の 1/10 の分子量(15 kDa)であり、抗体ではアプローチがむずかしい細胞内にアクセスできます(図1参照)。さらにターゲット分子との結合様式が抗体とは異なり多様性に富むので、今まで認識できなかったエピトープを同定する可能性を秘めています。また小さくシンプルな構造であることから、それぞれの nanobody を連結させることにより、同時に複数のエピトープへ結合させる研究もすすんでいます。抗原や病気の原因となるタンパク質の重要な領域を複数みつけ、それらの部位を異なる nanobody で同時に阻害することは、より強い薬の効果が期待できます。
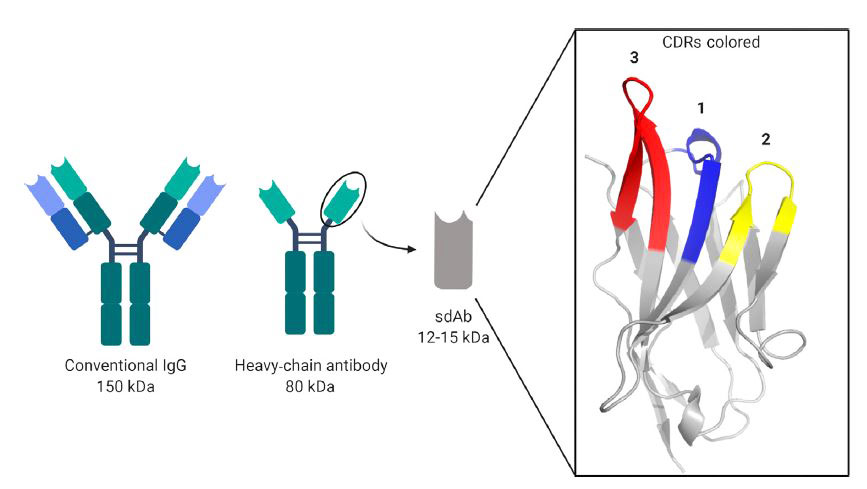
図1: Structures of Conventional, HCAb and sdAbs.
Trends in Microbiology, March 2021, Vol. 29, No. 3
Slaying SARS-CoV-2 One (Single-domain) Antibody at a Time
Timothy F. Czajka, David J. Vance, and Nicholas J. Mantis
Figure 1.より抜粋
図1の解説;Structures of Conventional, HCAb and sdAbs.
(左)IgG抗体;H鎖とL鎖のペアから構成され「Y字」のような形をとる。
(中央)ラクダ科の動物(アルパカやラマ)はH鎖のみから構成される抗体をもつ。
(右)H鎖抗体の可変領域;nanobodyまたはsdAbs(single-domain antibodies)。
(構造)nanobodyのCDRs(complementarity determining regions;青、黄と赤)。
Image created in BioRender.
昨今では nanobody library から特異的な遺伝子をスクリーニングし、そこから得られた情報をベースに最終産物を大量に微生物宿主で生産させることができます。これは nanobody の構造の安定性がとても高いことにも由来します。課題は抗体にくらべ半減期が短いことでしたが、この点もすでにクリアし、抗体とおなじくらいに体内にて存続させる技術も開発されています。さらに COVID-19 への中和 nanobody の報告も複数されており、今後も目が離せない技術のひとつとなってきています。
先に述べたように nanobody の結合様式は豊富なため、おおきなメリットと考えられています。ひとつには、ターゲット分子の「凹凸やポケット」を好んで認識することがあげられます。ここでターゲット分子が細胞内のシグナル伝達に重要なタンパク質である場合を考えてみましょう。とある nanobody は細胞膜を通過することができますので、細胞表面に局在している分子をターゲットとする抗体にくらべると用途は広がります。
米国フロリダに拠点を構えるスタート・アップ企業 Singh Biotechnology では細胞内の環境で機能する nanobody の創薬をめざし「細胞内抗体」の開発に力をそそいでいます。ターゲットは「がん」にかぎらず自己免疫疾患、目の疾患や伝染病と広範囲におよびます。代表的な商品として SBT-100 があります。これは bi-specific nanobody でおおくの「がん」で変異がみつかっている *KRAS と **STAT3 の両者に結合するうえ、細胞膜と脳関門を通過することができます。両者は細胞内のシグナル伝達経路の ON/OFF をコントロールし、細胞分化、細胞成長やアポトーシスを適切に制御しています(図2参照)。
*KRAS (Kirsten rat sarcoma 2 viral oncogene homolog)は GTP が結合することで活性化する small GTPase で molecular switch として下流のシグナル伝達経路を制御する。GTP への結合に重要な役割をになう 12 または 13 番目の G(グリシン)が D(アスパラギン酸)に置換される変異が良く知られている。ヒトの「がん」でみられる変異の約 25% を占める。
**STAT3 (signal transducer and activator of transcription 3)は、細胞質でリン酸化されることで homo-dimer をつくり活性化する。つづいて核内へ移行し DNA に結合することで転写を制御する。ヒトの「がん」の 50-90% で過剰発現している。
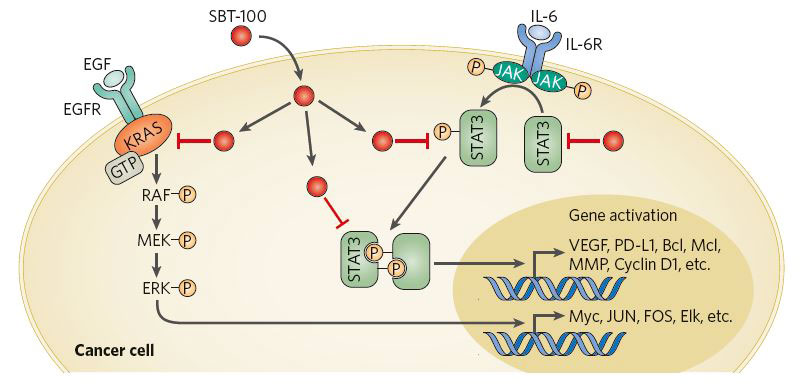
図2: The multiple modes of action of SBT-100
Single domain antibodies-minimalist binders for maximal therapeutic efficacy
Singh Biotechnology. ( http://www.singhbiotechnology.com )
Biopharma Dealmakers (Biopharm Deal)
Figure 2.より抜粋
図2の解説;The multiple modes of action of SBT-100
SBT-100 は KRASとSTAT3 の両者の「はたらき」を抑制する bi-specific nanobody であり、「がん細胞」などでみられるシグナル伝達経路の「乱れ」を正常化していきます。これらは VEGF や IL-6 により調節されるシグナル伝達経路も含む。 EGF, epidermal growth factor; EGFR, epidermal growth factor receptor; ERKs, extracellular signal-regulated kinases; GTP, Guanosine-5′- triphosphate; IL-6, Interleukin 6; JAK, Janus kinases; MMP, matrix metalloproteinases; PD-L1 programmed death-ligand 1; VEGF, vascular endothelial growth factor.
Singh Biotechnology の製品である SBT-100(bi-specific nanobody)は、KRAS の変異(G12D/G13D)やリン酸化 STAT3 に nM(KD)レベルでタイトに結合することが実証されています。さらにin vitro(「乳がん」または「膵臓がん」由来の cell-line)や in vivo(mouse xenograft)の実験においても nM の濃度で「がん細胞」の生存率や「がん」の成長を顕著に抑制する効果が確認されています。
分子レベルの観点からは、免疫チェックポイント阻害剤の効果を高めることが示唆されています。SBT-100 を「乳がん」由来の cell-line に処理すると、STAT3 の活性化を抑えるだけでなく STAT3 そのもののタンパク質量をも減らすことが確認されました。STAT3 のターゲットは「がん」の生存、成長、血管新生、転移や免疫抑制に関わる遺伝子群であることです(図2参照)。
その効果は免疫チェックポイントに関わる PD-L1 (programmed death-ligand 1)においても確認されています。SBT-100 による STAT3 の抑制は PD-L1 の発現を 48 時間で 94% 減らすことに成功しました。悪性腫瘍の 50% 以上は STAT3 のシグナル伝達経路を利用しているので、SBT-100 は「がん」全般に効果をもたらすことが考えられます。
遺伝子工学の観点からも nanobody は評価が高いことがわかっています。理由としてあげられるのは、操作がしやすいので複数の nanobody をペプチドなどのリンカーでつなぐことが容易であることです。homo や hetero-dimer など臨床開発にて活躍が期待されるものが多いです。また「がん」の生存に関わる遺伝子は変異の頻度が高く、さらに蓄積されていくことが報告されています。これらに対する抗原には複数の結合部位を異なる nanobody に認識させることにより、薬剤への耐性を回避することが期待されています。
新たな抗体医薬を開発するため、莫大な数の nanobody を候補として研究員は継続的に調べていく必要があります。特に下記の2つが大事になります…、
- プラスミド DNA の精製 → 微生物への transformation → nanobody の産生
- Nanobody の精製(Tagged protein) → クオリティ評価 → 動物や人体への投与
これらを「ひとつずつ」マニュアルで検証していくと莫大な労力、時間や資金を要します。
それゆえに「同じ条件」で「再現性高く」これらのステップをおこなうには、ロボットによるオートメーションが求められてくるでしょう。
このような要求に応えられるよう、わたしたち Biotage®はオートメーションに適した製品を数おおく提供しています。 PhyTip®カラムはタンパク質、抗体やペプチドの精製に適した製品であり、さまざまなアプリケーションに対応しているので、主要なリキッド・ハンドラーに搭載することができます。PhyTip®カラムは「Lab オートメーション」を推しすすめ、研究者をルーティンから解放することで「貴重な時間」を提供しています。
参考文献
- Single domain antibodies-minimalist binders for maximal therapeutic efficacy
(https://www.singhbiotechnology.com/)
Biopharma Dealmakers (Biopharm Deal)
September 2021 B36-37 - Slaying SARS-CoV-2 One (Single-domain) Antibody at a Time
Timothy F. Czajka, David J. Vance, and Nicholas J. Mantis
Trends in Microbiology, March 2021, Vol. 29, No. 3